산화물은 이원 화합물입니다. 즉, 단 두 개의 화학 원소에 의해 형성되며 가장 전기 음성이 높은 산소는 산소입니다. 일상 생활에 존재하는 가장 중요한 산화물 중 일부를 아래에서 확인하십시오.
- 칼슘 산화물 (CaO) :
이 화합물은 생석회 또는 생석회로 알려진 흰색 분말로 물과 반응하면 수산화칼슘 (Ca (OH))을 생성합니다.2), 소석회, 소석회 또는 수화 석회로 알려져 있습니다. 이베이스는 벽에 흰색 도료를 칠하고 침투로부터 보호하며 나무에 벌레를 물리 치는 데 사용됩니다.

산화 칼슘은 산성 토양의 pH를 보정하기 위해 농업에서 널리 사용됩니다. 그러나 CaO는 피부에 존재하는 물과 반응하여 화상을 일으키기 때문에이 도포 방법에주의 할 필요가 있습니다. 또한 호흡기도 손상을 일으키고 실명을 유발할 수 있습니다.
CaO의 다른 용도는 다음과 같습니다. 건축, 모르타르, 시멘트 및 세라믹 준비; 야금 벽돌 제조, 물 및 하수 처리, 살충제 및 살균제, 설탕, 식물성 기름 및 과일 주스의 정제, 유리 생산, Na2CO3 및 CaCl (ClO).
- 산화 마그네슘 (MgO) :
MgO는 널리 사용되는 백색 분말로 물과 혼합되어 마그네시아 우유로 알려진 용액을 형성합니다. 위의 염산과 반응하여 환경을 중화시켜 위산 제산제로 사용됩니다.

- 실리콘 산화물 (SiO2):
SiO2 그것은 실리카로 알려져 있으며 모래에 존재하며 석영, 토파즈 및 자수정과 같은 결정 형태로도 발견됩니다.

모래의 실리카는 소다회 (Na)와 함께 유리 생산에 사용됩니다.2CO3) 및 석회암 (CaCO3). 이러한 화합물이 1500ºC의 온도로 가열되면 나트륨과 칼슘 규산염의 혼합물이 형성되고 냉각되어 우리가 알고있는 유리를 형성합니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
에서2CO3 + CaCO3 + SiO2 → 규산 나트륨 및 칼슘
재 + 석회암 + 모래 → 유리

- 일산화탄소 (CO) :
일산화탄소는 불완전 연소로 방출되는 오염되고 극도로 독성이 강한 가스입니다. 이 가스에 대한 노출은 석유 제품 및 담배 연기와 같은 화석 연료의 연소로 인한 오염을 통해 발생할 수 있습니다.

CO는 또한 제철소에서 금속 철을 생산하는 데 사용되어 적철광에서 산화철 III을 감소시킵니다.
- 이산화탄소 (CO2 – 이산화탄소로 알려짐) :
그는 온실 효과, 지구 온난화 및 산성비와 같은 환경 문제의 주요 원인 중 한 명입니다. 그것은 체질에 탄소를 포함하는 연료의 완전 연소와 우리의 호흡에 의해 방출됩니다.
이것은 청량 음료와 탄산수에 존재하는 가스입니다. 고체 상태에서는 드라이 아이스라고하며 승화 특성, 즉 통과 고체에서 기체 상태로 직접적으로 콘서트, 극장, 파티에서 자주 사용되는 흰 연기를 방출합니다. 그리고 영화.
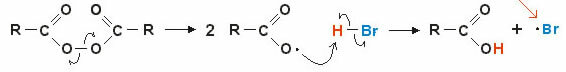
- 과산화수소 (H2영형2):
수용액에서 과산화수소는 과산화수소라고 불리며 방부제 및 표백제로 사용됩니다 (3 %). 고농도에서는 모발과 모발을 밝게하는 데 사용됩니다. 30 % 이상의 농도에서는 목재 표백제, 섬유 섬유 및 로켓 추진과 같은 산업에서 사용됩니다.
작성자: Jennifer Fogaça
화학 전공
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
FOGAÇA, Jennifer Rocha Vargas. "일상 생활의 주요 산화물"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/principais-Oxidos-cotidiano.htm. 2021 년 6 월 28 일 액세스.
화학

이원 화합물, 과산화물은 청징 제, 직물 표백제, 셀룰로오스 펄프, 모르타르 준비, 생석회, 드라이 아이스, 과산화수소, 과산화수소로 사용됩니다.
화학

산화 질소, 친 유성, 내피 세포에 의해 합성, 기체 자유 라디칼, 공정 세포 내 및 세포 외, 혈류, 근육 혈관 확장, 보충제 음식.