영형 pH 용액의 양은 하이드로 늄 이온 (H)의 함량 (측정)을 나타냅니다.3영형+) 중간에 있습니다. 이 내용은 분석 된 용액에 산성, 염기성 또는 중성 특성이 있는지 여부를 결정합니다.
관측: 하이드로 늄 함량 (H3영형+ 또는 H+) pH 표시기 테이프를 사용하여 실험실에서 간단히 획득 할 수 있지만 정확도가 높지 않습니다. 측정에서-또는 Peagometer라고 불리는 장비를 사용하여 반대로 pH를 측정하는 데 큰 정확성을 갖습니다. 해결책.
용액의 pH를 측정하기위한 보수계 또는 전위차계
수행하려면 pH를 포함하는 계산 솔루션의 경우 다음과 같은 로그 방정식을 사용할 수 있습니다.
pH =-로그 [H3영형+]
또는
pH =-로그 [H+]
중대한: 용액의 pH와 관련된 계산에서는 항상 밑이 10 인 로그를 사용합니다.
마인드 맵: 솔루션 PH 계산

* 마인드 맵을 PDF로 다운로드하려면 여기를 클릭하세요!
위의 대수 방정식에서이 방정식의 다음 단순화 (대수 함수를 적용하여 얻음)를 사용할 수 있습니다.
[H3영형+] = 10-pH
관측: 위의 간단한 표현은 pH 값이 정수인 경우에만 사용할 수 있습니다. 그렇지 않으면 로그 함수를 사용해야합니다.
용액의 pH와 관련된 계산은 항상 pOH (하이드 록실 이온 전위 / OH)와 관련이 있음을 강조하는 것이 중요합니다.-), 두 효능 모두 물의자가 이온화 (Kw = 10-14, 물이 너무 많은 H를 생성하는 현상+ 얼마나 오-) 및 Ostwald의 희석 법칙 (용액이 더 희석 될수록 H 양이온의 양이 많아집니다.+ ). 그러므로:
약 물 자동화:
케이w = [H+]. [오-]이므로 pH + pOH = 14
법칙 Ostwald 희석(이를 통해 특정 물질이 물에서 이온화되거나 해리되는 정도를 알 수 있습니다) :
케이나는 = M.α2
Ki = 수성 매질에서 물질의 이온화 상수;
M = 수성 매질에서 물질의 몰 농도 또는 몰 농도;
α2 = 매체 내 물질의 이온화 또는 해리 정도.
용액을 산성, 염기성 또는 중성으로 분류하는 기준은 다음과 같습니다 (a 25 영형씨):
-
하나 솔루션은 중립적입니다 H의 농도+ OH의 농도와 동일- 또는 pH가 7입니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
[H+] = [OH-]
하나 용액은 산성이 될 것입니다 H의 농도+ OH 농도보다 큽니다.- 또는 pH는 0과 7 사이입니다.
[H+]> [OH-]
하나 해결책은 기본이 될 것입니다 H의 농도+ OH 농도보다 낮음- 또는 pH는 7과 14 사이입니다.
[H+] -]
용액의 pH와 관련된 몇 가지 계산 예를 참조하십시오.
1º)커피의 하이드로 늄 농도가 1.10임을 알기-5,이 용액에 존재하는 pH는 얼마입니까?
운동하는 방법 하이드로 늄 농도 제공 커피를 위해 우리는 할 수 있습니다 단순화 된 pH 공식 사용:
[H3영형+] = 10-pH
1.10-5 = 10-pH
10-5 = 10-pH
-5 = -pH
pH = 5
pH가 7보다 작기 때문에 용액은 산성입니다.
2º) (UFU) K를 가정 할 때 0.045 mol / L 아세트산 용액의 pH는 얼마입니까?나는 = 1,.10-5? 데이터: log 2 = 0.3; 로그 3 = 0.48.
운동 데이터 :
M = 0.045 몰 / L
케이나는 = 1,8.10-5
로그 2 = 0.3
로그 3 = 0.48
운동이 제공 한 방법 몰 농도 (M) 및 이온화 상수 (K나는),먼저 언급 된 산의 이온화 정도를 결정 해 보겠습니다. 하이드로 늄 (H3영형+ 또는 H+)는 항상 몰 농도와 이온화 정도를 곱한 결과입니다. 곧:
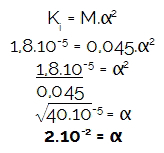
다음으로 몰 농도를 곱한 하이드로 늄의 양 발견 된 이온화 정도에 따른 산의 :
[H3영형+] = M.α
[H3영형+] = 0,045.2.10-2
[H3영형+] = 0,09.10-4
[H3영형+] = 9.10-4 정부
마지막으로 대수 pH 방정식의 하이드로 늄 농도 값:
pH =-로그 [H3영형+]
pH =-로그 9.10-4
pH = 4-로그 9
pH = 4 로그 32
pH = 4-2. (로그 3)
pH = 4- (2.0.48)
pH = 4-0.96
pH = 3.04
pH가 7보다 작기 때문에 용액은 산성입니다.
3º)(Cefet-PR) A 45 영형C, 중성 용액의 Kw는 4.10과 같습니다.-4. 그렇다면이 온도에서이 용액의 pH 값은 얼마입니까? 로그 2 데이터 = 0.3.
연습이 해결책을 알려주는 방법 중립국, 곧 [H3영형+]는 [OH-]:

마지막으로 대수 pH 방정식의 하이드로 늄 농도 값:
pH =-로그 [H+]
pH =-로그 2.10-7
pH = 7-로그 2
pH = 7-0.3
pH = 6.7
pH가 거의 7이므로 온도가 45이므로 용액은 중성입니다 (운동 설명에 표시된대로). 영형씨.
나로. Diogo Lopes Dias
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
일, Diogo Lopes. "용액의 pH를 포함하는 계산"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/calculos-envolvendo-ph-solucoes.htm. 2021 년 6 월 28 일 액세스.
Ostwald의 법칙, 이온화 상수, 몰 농도, 이온화 정도, 약한 전해질, 이온화 된 몰 수, Friedrich Wilhelm Ostwald, 일산, 단 염기.


