그만큼 소금 다리 영국의 화학자 Frederic Daniell이 1836 년에이 학자가 배터리 그의 이름을 딴 (Danill 's Pile). 이 다리 두 개의 다공성 끝이있는 U 자형 튜브입니다. (목화 또는 한천으로 구성) 물과 소금으로 형성된 수용액을 포함합니다. 이것은 전지의 두 반쪽 전지 (양극과 음극)의 용액을 간접적으로 연결합니다.
관측: 양극은 배터리의 음극으로 산화가 일어나는 곳이고 음극은 양극이며 환원이 일어나는 곳입니다.
소금 다리의 중요성을 이해하려면 처음에는 말뚝의 기능을 이해해야합니다. 아래 다이어그램을 참조하십시오.
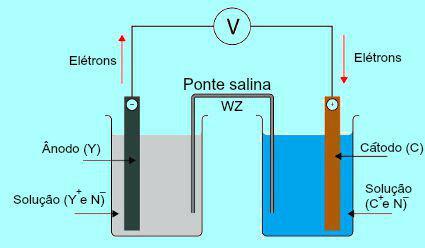
Daniell 스택의 일반 계획
처음에는 양극에 존재하는 판의 금속 (Y)이 산화됩니다. 산화를 겪을 때 금속은 양이온으로 변하여 판이있는 용액으로 떨어집니다. 이러한 이유로 양극 용액은 더 높은 농도의 양이온 (Y+). 이 경우 양극 금속판의 감소가 관찰됩니다.
Y → 및- + Y+
그런 다음 양극판의 금속이 산화되는 동안 손실 된 전자는 외부 전선을 통해 이동하여 음극에있는 금속판으로 이동합니다. 따라서 음극에 존재하는 판은 전자로 충전됩니다.
-
현재 양이온 (C+) 용액에서 전자가 충전되기 때문에 음극판으로 이동합니다. 양이온은 판에 존재하는 전자를 얻을 때 중성 (안정적이고 단단함)이되어 부착됩니다. 이러한 이유로 음극 용액은 양이온보다 더 높은 농도의 음이온을 나타냅니다. 이 경우 음극 금속판의 크기 증가가 관찰된다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
씨+ + 및- → C
방법에 대한 이해에서 다니엘의 더미, 양극에 존재하는 용액이 더 많은 양의 Y 양이온을받는 것을 관찰 할 수 있습니다+ X 플레이트의 금속 산화로 인해. 반면에 음극에 존재하는 용액은 양이온 (C+) 플라크 감소로 고통 받기 때문입니다.
소금 다리의 작업이 강조되는 것은 정확히이 문제에 있습니다. 이 브리지의 주요 기능은 양극 및 음극 용액에 존재하는 전하 균형을 촉진하는 것입니다. 소금 다리에는 항상 물에서 해리 된 소금 (일반적으로 염화칼륨 또는 질산 암모늄)이 있습니다. 소금 다리의 방정식 표현을 참조하십시오.
WZ + H2O → W+ + Z-
염다리에는 두 개의 이온 (W+ 및 Z-)에 따라 음극과 양극으로 이동합니다.
그만큼) 양극은 음이온 (Z-) 원소 (Y)의 산화로 인해 염다리에 존재하여 양이온 (Y)의 양을 증가시킵니다.+).
비) 음극은 양이온 (W+) 배터리 작동 중 양이온 (C+) 솔루션에 존재하는 것은 보드에서 감소합니다. 따라서 음극 용액은 더 많은 양의 음이온 (N-) 따라서 소금 다리에 존재하는 양이온을받습니다.
나로. Diogo Lopes Dias
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
일, Diogo Lopes. "세일 브리지"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. 2021 년 6 월 28 일 액세스.


