에서 분자간 힘, 일반적으로 Van der Waals Forces, 세 가지가 있습니다. 유도 쌍극자 유도 쌍극자, 수소 결합 및 영구 쌍극자-영구 쌍극자. 이 텍스트에서는 다음 세 가지 힘 중 마지막 힘만 고려할 것입니다.
전원 영구 쌍극자-영구 쌍극자또는 간단히 쌍극자 쌍극자 에서만 발생 극성 분자즉, 표면을 따라 균일 한 하중 분포를 갖지 않는 것입니다. 예를 들어, HCl 분자 (염산 가스)에서 전자 구름은 수소보다 전기 음성 적이기 때문에 염소 원자쪽으로 더 많이 변위됩니다.
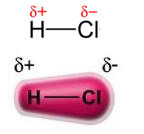
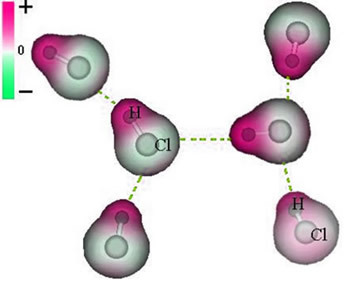
염소 원자 주변에는 전자가 축적되어 음극, 그리스 문자 델타로 상징됩니다. (-δ). 결과적으로 수소 원자 주변 영역에서 양극 (+δ), 전자 밀도가 낮기 때문입니다. HCl 분자는 다음을 구성합니다. 전기 쌍극자 따라서 다른 인접한 HCl 분자와 접촉 할 때 아래에서 볼 수 있듯이 분자의 반대 극 사이에 인력이 있습니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
이 인력은 한 분자의 쌍극자의 음의 끝과 다른 분자의 쌍극의 양의 끝 사이에 형성되어 쌍극자-쌍극자 힘을 구성합니다..
따라서 이름에서 알 수 있듯이 쌍극자는 영구적이므로 극성 화합물에서만 발생합니다. 분자의 극성이 높을수록 물질의 쌍극자-쌍극자 상호 작용이 더 강해집니다.
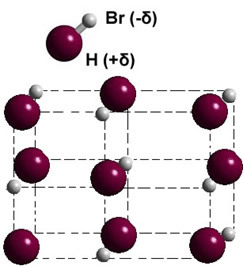
고체상 인 경우 영구 쌍극자의 형성은 공간에서 각 분자의 위치를 안내하여 쌍 극성 결정; 아래 그림과 같이 브롬화 수소의 경우 :
분자 사이에 쌍극자-쌍극자 강도를 갖는 극성 물질의 다른 예는 다음과 같습니다.2S, CO, HCCl3, 뿐2.
이 분자간 힘은 중간 강도, 유도 된 쌍극자 유도 쌍극자 인력보다 강하지 만 수소 결합보다 덜 강하기 때문입니다. 이것이 그들의 녹는 점과 끓는점이 유도 된 쌍극자 강도를 갖는 물질보다 높은 이유입니다. 영구 쌍극자 힘이 강해짐에 따라 분자의 상호 작용이 분해되도록 더 많은 에너지를 공급해야합니다.
작성자: Jennifer Fogaça
화학 전공
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
FOGAÇA, Jennifer Rocha Vargas. "쌍극자-쌍극자 분자간 힘";
브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/forca-intermolecular-dipolo-dipolo.htm. 2021 년 6 월 27 일 액세스.e) OS2, HBr, HCl, H2영형.
c) CH의 끓는점을 아는 것3Cl 및 CH3I는 각각 24.0 ° C와 42.4 ° C이며, 어떤 화합물이 액체 상태에서 더 강한 분자간 힘을 나타내는 지 나타냅니다.

