활성 이성질체 또는 광학 활성 이성질체 (IOA)는 분극화 및 편향을 수행 할 수있는 특정 화학 물질의 분자입니다. 계획 빛 오른쪽 아니면 왼쪽. 물질에 활성 이성질체가 있는지 확인하려면 구조식에 비대칭 탄소가 있는지 확인하십시오.

위 이미지에 표시된 체인을 분석하면 중심 탄소에는 4 개의 다른 리간드가 있습니다. (오, H, CH3 및 Cl), 따라서 탄소 비대칭, 탄소라고도 함 키랄. 따라서 사슬에 하나 이상의 키랄 탄소가있을 때마다 활성 이성질체가 있습니다.
당신 활성 이성질체 유형(IOA) 그들은:
오른 손잡이: 편광 된 빛을 오른쪽으로 구부리는 활성 광학 이성질체;
Levogiro : 편광 된 빛을 왼쪽으로 구부리는 활성 광학 이성질체.
관측: 구조식에서 비대칭 탄소의 존재는 물질이 좌회전 이성질체 및 dextrorotatory 이성질체를 가져야 함을 나타냅니다. 키랄 탄소의 존재는 이미이 사실을 증명하기 때문에 빛이 어느 방향으로 편향되었는지 아는 것은 우리에게 달려 있지 않습니다. 기존 분자의 절반은 항상 왼손잡이이고 나머지 절반은 오른 손잡이입니다.
모든 유기 물질의 왼손잡이 및 오른 손잡이 분자는 항상 동일한 물리적 특성 (점 녹는 점, 끓는점, 밀도, 용해도 등), 그러나 현재 화학적 활동 (생물체의 행동) 많이 다릅니다. 예를 들어 아드레날린이 있습니다. 아드레날린 levogyra 분자 만 신체에서 작용하는 반면 dextrogyra는 그렇지 않습니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
이제 부탄 -2- 올 물질의 구조식을보고 활성 이성질체가 있는지 확인하십시오.
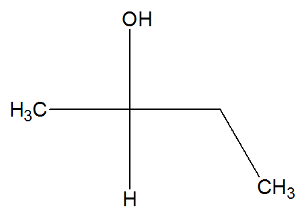
우리는 부탄 -2- 올의 구조에서 탄소 2가 네 가지 바인더 (오, H, CH3, CH2-CH3), 그래서 그것은 키랄 탄소이고 dextrorotatory active isomer와 다른 levorotary active isomer를 제공합니다..
활성 이성질체 (IOA) 계산
네덜란드 화학자 Jacobus Henricus van't Hoff 주어진 물질이 얼마나 많은 활성 이성질체 (IOA)를 나타낼 수 있는지 계산할 수있는 공식을 개발했습니다. 보기:
IOA: 2아니
엔: 물질의 구조식에있는 키랄 탄소의 수입니다.
Vant't Hoff 공식 적용의 두 가지 예를 따르십시오.
5- 디클로로 -2,3- 디 히드 록시-헥산 디오 산

화합물의 구조식에는 세 가지가 있습니다. 키랄 탄소 또는 비대칭이므로 :
IOA = 2아니
IOA = 23
IOA = 8
2,3,4,5- 테트라 히드 록시 헥사 날

화합물의 구조식에는 네 가지가 있습니다. 키랄 탄소 (빨간색 화살표) 또는 비대칭이므로 :
IOA = 2아니
IOA = 24
IOA = 16
관측: 구조식이 정확히 동일한 리간드를 갖는 두 개의 비대칭 탄소를 가질 가능성이 있습니다. 이것이 발생하면 계산에서 n 값에 대해 2가 아닌 1 만 고려합니다. 예를 참조하십시오.
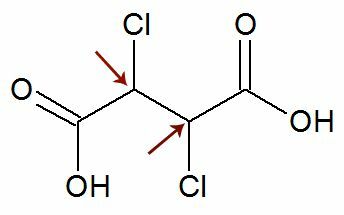
처럼 두 개의 키랄 탄소 그들은 같음, 우리는 하나만 고려 계산에서 탄소 :
IOA = 2아니
IOA = 21
IOA = 2
나로. Diogo Lopes Dias
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
일, Diogo Lopes. "활성 이성질체"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm. 2021 년 6 월 27 일 액세스.


