그만큼 소금 가수 분해 강산과 염기 사이 염의 양이온이 물의 음이온과 상호 작용하지 않고 소금의 음이온이 물의 양이온과 상호 작용하지 않을 때 발생합니다. 소금과 물의 양이온과 음이온 사이의 가수 분해는 형성된 생성물이 약산, 약염기 또는 둘 다일 때만 발생합니다. 강산과 강염기 사이의 염 가수 분해를 단계별로 이해합니다.
a) 1 단계: 물 이온화
물은 고통을 겪을 수있는 물질입니다 자동화즉, 하이드로 늄 양이온 (H+) 및 수산화 음이온 (OH-) 구조에서.
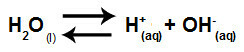
물의자가 이온화를 나타내는 방정식
b) 2 단계: 분리 소금의
물에 소금을 넣으면 해리 과정을 거칩니다. 소금은 이온 화합물이기 때문에 물에서 양이온과 음이온이 아래 방정식과 같이 매질로 방출됩니다.
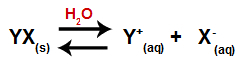
소금의 해리를 나타내는 방정식
c) 3 단계: 강산 및 염기의 염 가수 분해
강산의 경우 : 소금의 음이온이 H와 결합되었을 때+ HCl, HBr, HI 또는 수소 수에 의한 산소 수의 뺄셈이 2보다 크거나 같은 다른 산을 형성하는 물의 강산. 따라서 언급 된 이온 간의 조합이 발생하지 않습니다.
강력한 기반 : IA (알칼리 금속) 또는 IIA (마그네슘 이외의 알칼리 토금속) 계열에 속하는 염의 양이온이 OH와 결합 될 때- 물의, 그것은 형성 할 것입니다 강력한 기반. 따라서 언급 된 이온 간의 조합이 발생하지 않습니다.
소금 이온이 물 이온과 상호 작용하지 않으면 다음 방정식이 있습니다.
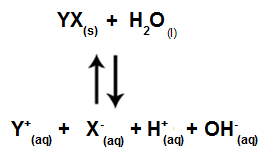
용액에 존재하는 모든 이온을 보여주는 방정식
요약하면, 소금 이온은 물 이온과 상호 작용하지 않기 때문에 소금 이온은 최종 용액의 변화를 촉진하지 않습니다. 따라서 우리는 물 이온화 방정식만으로 강산과 강염기 사이의 염 가수 분해 방정식을 쓸 수 있습니다.
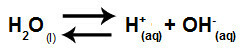
강산과 염기의 가수 분해를 나타내는 방정식
d) 강산과 염기 사이의 염 가수 분해의 예
물에 염소산 칼륨 염 (KClO3), 염은 칼륨 양이온 (K+) 및 염소산 음이온 (ClO3-) 중간에.
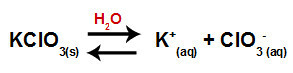
염소산 칼륨에 대한 해리 방정식
물은자가 이온화를 거쳐 매질에 하이드로 늄 양이온 (H)을 제공한다는 것을 기억하는 것이 중요합니다.+) 및 수산화 음이온 (OH-). 이제 소금과 물 이온 사이의 상호 작용을 평가해야합니다.
H+ ClO와 상호 작용3-, 과염소산 (HclO3). 과염소산에서 이온화 가능한 수소의 수로 산소의 수를 빼는 것이 2이므로 강하다. 따라서 이온 간의 상호 작용이 발생하지 않습니다.
K 양이온+ OH 음이온과 상호 작용-, 우리는 칼륨이 알칼리 금속이기 때문에 강한 염기를 형성합니다. 따라서 이온 간의 상호 작용이 발생하지 않습니다.
물에 염소산 칼륨이 용해되어 강산과 염기 사이의 염 가수 분해를 나타내는 방정식은 다음과 같습니다.
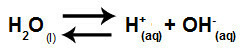
염소산 칼륨 가수 분해의 화학 방정식
나로. Diogo Lopes Dias
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/hidrolise-salina-entre-acidos-bases-fortes.htm
