일반적으로 치환 반응은 탄화수소 분자의 하나 이상의 수소 원자가 치환기로 대체되는 반응이다.
1- 질화: 질산 (HNO3) 및 유기 화합물.
예: 벤젠과 질산 사이의 반응.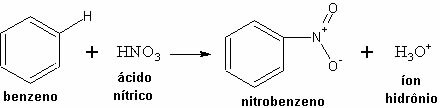
벤젠은 황산 (H)이있는 상태에서 질산과 반응 할 수도 있습니다.2뿐4) HNO보다 강한 산3, 루이스 염기처럼 행동하여 H로부터 양성자를받습니다.2뿐4. 프로세스를 나타내는 방정식을 참조하십시오.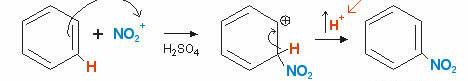
이 질화 반응에서 산-염기 균형이 발생합니다.
2- 설 폰화:이 반응은 반응물 (H2뿐4).
예: 벤젠 고리의 설 폰화.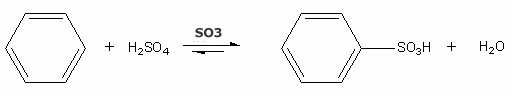
반응은 촉매-삼산화황 (SO3)의 존재하에 일어나며 가열하에 수행됩니다. 반응의 생성물은 벤젠 술폰산과 물입니다.
3- 할로겐화: 이름 에서조차 Halogenation에서는 수소 원자가 할로겐 원자 (F, Cl, Br, I)로 대체되는 것으로 추론 할 수 있습니다. 가장 흔한 것은 염소화와 브롬화입니다.
예: 프로판 모노 브롬화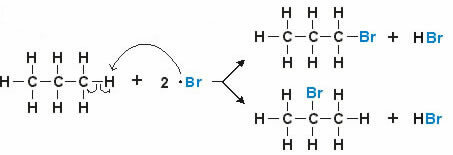
프로판 분자의 리간드 H는 리간드 Br로 대체되어 1- 브로 민 프로판 또는 2- 브로 민 프로판을 생성합니다.
참고: 두 개의 화살표는 할로겐 (브로 민)이 구조의 모든 수소를 대체 할 수 있음을 나타냅니다.
예: 벤젠의 염소화.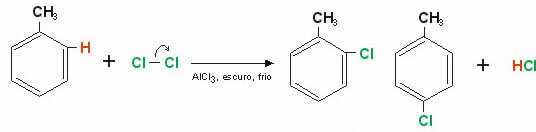
벤젠 고리에 존재하는 수소 원자 중 하나가 원자로 대체되었습니다. 염소, 이것은 오르토와 파라 위치를 모두 차지할 수 있으므로 생성물: o- 클로로 벤젠 또는 p- 클로로 벤젠.
리리아 알베스
화학 전공
브라질 학교 팀
더보기!
탄화수소 지점
유기 화학 - 화학 - 브라질 학교
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/reacoes-substituicao-hidrocarbonetos.htm
