확산 및 삼출 스코틀랜드의 화학자 Thomas Graham이 19 세기에 제안한 두 가지 법칙은 가스 혼합물 그리고 행동 가스 컨테이너 벽을 통과 할 때.
확산 및 삼출과 관련된 가스의 거동에 대한 Thomas Graham의 관찰 중 다음을 강조 할 수 있습니다.
기체는 항상 고체 물질에 존재하는 작은 구멍을 통과하는 경향이 있습니다.
클수록 분자 질량 가스, 고체 물질의 구멍을 통과하는 것이 더 어렵습니다.
가스의 밀도가 낮을수록 이동 속도가 빨라집니다.
가스가받는 온도가 높을수록 환경으로 퍼지거나 오리피스를 통과하는 속도가 빨라집니다.
- 가스는 특정 위치에서 정적 상태를 유지하지 않습니다.
확산
확산 가스가 영역의 공간 전체 또는 컨테이너 내부에 확산 (즉, 확산)하는 능력으로 구성된 물리적 현상입니다. 이런 이유로 우리는 공간 내에서 가스가 한 위치에 한정되지 않는다고 말할 수 있습니다.

방송 발생의 표현
또한 다음을 정의 할 수 있습니다. 확산 동일한 용기에 넣었을 때 하나의 가스가 다른 가스와 혼합되어 균질 한 가스 혼합물을 형성해야하는 용량입니다.
예를 들어 차량 배기 가스에서 가스가 나오는 경우입니다. 독성이 있기 때문에 대기를 통해 확산되어 결과적으로 농도가 감소하기 때문에 인간에게 단기적인 피해를주지 않습니다.
유출
유출 그것은 특정 용기의 벽에 존재하는 구멍을 통해 가스가 통과하는 것으로 구성되는 물리적 현상, 즉 한 환경에서 다른 환경으로 가스가 빠져 나가는 것으로 구성됩니다.

쏟아지는 사건의 표현
예를 들어, 파티를 위해 풍선이 부풀어지고 다음 날 풍선에 포함 된 구멍을 통해 빠져 나가는 공기 때문에 풍선이 모두 수축됩니다.
확산 및 삼출 관련 계산
Graham이 제안한 방정식에 따라 가스가 수행하는 속도를 계산할 수 있습니다. 확산 또는 삼출. Graham에 따르면 컨테이너에 혼합 된 두 가스의 확산 및 유출 속도는 다음과 같습니다. 상대 밀도 또는 몰 질량의 제곱에 항상 반비례합니다.
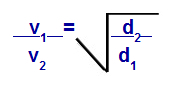
밀도에 관한 그레이엄의 법칙
V1 = 혼합물에서 가스 1의 속도 (삼출 또는 확산);
V2 = 혼합물에서 가스 2의 속도 (삼출 또는 확산);
디1 = 혼합물의 가스 1의 밀도;
디2 = 혼합물의 가스 2 밀도;
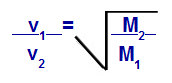
몰 질량에 관한 그레이엄의 법칙
V1 = 혼합물에서 가스 1의 속도 (삼출 또는 확산);
V2 = 혼합물에서 가스 2의 속도 (삼출 또는 확산);
미디엄1 = 혼합물의 가스 1의 몰 질량;
미디엄2 = 혼합물에서 가스 2의 몰 질량.
나로. Diogo Lopes Dias
출처: 브라질 학교- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm

