우리는 우리가 화학 반응에 참여하는 하나 또는 모든 반응물의 농도를 증가시킬 때마다 발생 속도, 즉 반응 속도가 증가합니다.
그 반대도 마찬가지입니다. 예를 들어, 현재는 일반 알코올 대신 알코올 젤을 사용하는 것이 좋습니다. 타는 위험이 적고 사고를 피할 수 있기 때문입니다. 일반 액체 알코올은 실제로 알코올과 물의 혼합물이며, 적은 양의 알코올을 포함하는 젤 알코올입니다. 따라서 연소 반응물 중 하나의 농도가 감소하면 알코올의 경우 반응이 더 느리게 진행된다. 반면에 알코올이 순수할수록 연소 반응이 빨라집니다.

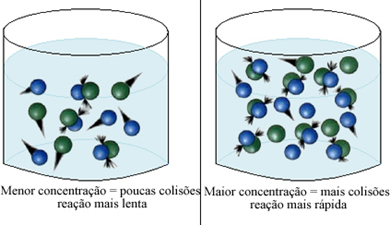
본문에 명시된 바와 같이 화학 반응 발생 조건, 반응이 일어나기위한 조건 중 하나는 효과적인 충돌 입자 사이. 그러므로, 시약의 농도가 증가하면 더 많은 양의 입자 또는 분자가 같은 공간에 갇혀있을 수 있습니다. 이것은 그들 사이의 충돌의 양을 증가시키고 또한 반응이 일어나게하는 효과적인 충돌이 발생할 가능성을 증가시킵니다. 그 결과 반응이 더 빨리 발생합니다.
이를 보려면 다음 예를 생각해보십시오. 불타는 불씨가 있고이 연소가 더 빨리 처리되기를 원할 때 불씨를 불거나 부채질합니까? 왜 이것이 작동합니까?
이 연소 반응의 반응물 중 하나는 공기 중의 산소입니다. 흔들리면 기류가 연소 중에 형성되는 재를 제거하여 산소와 불씨의 접촉을 용이하게합니다. 이러한 방식으로 반응물 간의 접촉을 증가시키고 연소 반응을 가속화합니다.
간단히 말하면 다음과 같습니다.

가스로 작업 할 때 반응물의 농도를 높이는 한 가지 방법은 압력을 낮추다. 이렇게하면 부피가 줄어들고 결과적으로 시약 농도가 증가합니다.

작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
