구조식은 요소 간의 결합을 나타내는 방법으로, 두 원자간에 공유되는 각 전자 쌍은 대시로 표시됩니다.
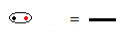
대시로 상징되는 공유 전자 쌍
즉, 단일, 이중 또는 삼중에 관계없이 모든 유형의 공유 결합이 구조식에 나타납니다.
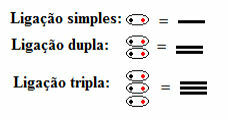
구조식에서 대시로 표시되는 단일, 이중 및 삼중 결합
결합이 거의없는 소분자 구조식의 몇 가지 예를 살펴보고 공유 전자 쌍이 어떻게 표현되는지 확인하십시오.
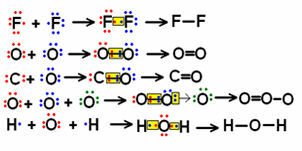
일부 분자에 대한 구조식의 예
전자 쌍이“점”으로 표시되는 왼쪽 위에 표시된 공식은 전자 공식 또는 루이스 공식. 이 분자들은 모두 무기 물질이지만 구조식은 일반적으로 유기 화합물의 경우 더 많이 사용됩니다. 광물 기원이 아닌 탄소 원소에 의해 형성된 것입니다 (일산화탄소 (CO)의 경우처럼 무기물).
탄소는 4가 (4 개의 공유 결합을 생성)이기 때문에 다른 원자 및 다른 탄소에 결합하여 무한한 사슬을 형성하는 능력 탄소. 이것이 구조식이 중요한 이유입니다.사슬의 원자 배열을 나타냅니다.
이해하려면 다음을 고려하십시오. 분자식 물질 분자에있는 각 원소의 수만을 나타냅니다. 예를 들어 분자식 C가 있다고 가정 해 보겠습니다.3H6, 우리는 그것이 3 개의 탄소 원자와 6 개의 수소 원자를 가지고 있다는 것을 압니다. 그러나 그것들은 어떻게 결합되어 있습니까? 구조식은 우리에게 이것을 말하고 실제로 그것이 어떤 화합물인지 알아낼 수 있습니다. 아래에서이 분자식은 두 가지 다른 구조식을 생성하고 결과적으로 두 가지 다른 물질을 생성 할 수 있습니다.

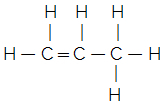
사이클로 프로판 프로필렌
이것들은 부를 수 있습니다평면 구조식, 모든 연결과 모든 요소가 종이, 칠판, 컴퓨터 화면 등의 평면에 그려집니다.
그러나 많은 탄소 사슬은 매우 크고 복잡하기 때문에 매번 구조식을 평평하게 작성하기가 어려울 것입니다.
따라서 분자 구조를 더 단순화 한 다른 형태의 표현이 만들어졌습니다. 첫 번째는 단순화되거나 축약 된 구조식, 각 탄소에 부착 된 수소 원자의 양은 기호 (H)를 넣어 축약합니다. 한 번만 오른쪽 하단에 지수를 추가하면 수소가 몇 개인 지 표시됩니다. 있습니다.
예를 들어, 일반적인 에테르의 평평한 구조식을 고려하십시오.
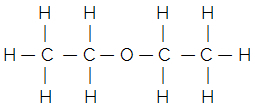
단순화되거나 축약 된 구조식은 다음과 같이 주어진다.
H3C — CH2 — O — CH2 — CH3
훨씬 간단하지 않나요?!
그러나 탄소는 항상 4 개의 결합을 만들고 수소는 하나의 결합만을 만든다는 것을 알고, 대시의 공식 인 또 다른 더 간단한 공식이 나타났습니다. 원하는 경우 텍스트에서 더 자세히 작성하는 방법을 볼 수 있습니다 유기 화합물의 분자식. 하지만 기본적으로이 공식에서는 그룹 C, CH, CH가 생략됩니다.2 및 CH3, 지그재그로 연결된 대시로 표시됩니다. 아래에 앞서 언급 한 에테르의 구조식이 있습니다.
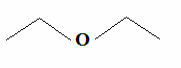
일반적인 에테르 추적 공식
그러나 물질 공식이 공간에서 정확히 평평하지 않다는 것은 사실입니다. 따라서 어떤 경우에는 더 공간적인 아이디어를 제공하기 위해 관점에서 공식, 링크는 원자가 평면 (일반 스트로크), 평면 뒤 (점선 쐐기) 또는 평면 앞 (전체 쐐기)에 있는지 여부 :

관점에서 수식 표현
예를 들어, 아래의 코티솔 공식을보십시오. 하나의 수소, 하나의 수산기 (OH) 및 두 개의 메틸기 (CH3 -생략 됨)은 평면 앞에 있고 두 개의 수소와 수산기가 평면 뒤에 있고 나머지는 평면에 있습니다.

코티솔 관점의 구조식
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-formula-estrutural.htm


