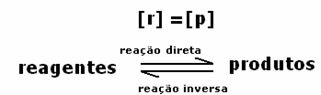
반응의 동적 평형 또는 화학적 평형은 순방향 및 역방향 반응이 동시에 발생할 때 발생합니다. 이러한 소위 가역 시스템은 양방향 화살표로 표시됩니다.  또는
또는  . 가역적 반응의 예는 요오드 가스와 수소 가스 사이의 위 이미지에 나와 있습니다.
. 가역적 반응의 예는 요오드 가스와 수소 가스 사이의 위 이미지에 나와 있습니다.
반응이 시작될 때 반응물의 양은 최대이고 생성물의 양은 0입니다. 그러나 반응물은 서로 반응하여 농도가 감소하고 형성된 생성물의 농도가 증가합니다. 직접 반응의 발달 속도도 감소하고 있습니다.
생성물의 농도가 증가함에 따라 역반응이 시작되고 반응물이 다시 형성됩니다. 역반응의 발달 속도도 증가합니다.
화학 평형에 도달하면 일정한 온도에서 순방향 및 역방향 반응의 발생 속도가 동일합니다.
모두곧장 = 모두 역
요금은 동일하지만 농도는 다릅니다. 시약과 제품의 농도는 같지 않을 것입니다. 드문 경우에만 이런 일이 발생합니다. 대부분의 경우 시약의 농도는 제품의 농도보다 높거나 그 반대의 경우도 마찬가지입니다.
따라서 우리는 개발 속도를 그래픽으로 표현할 수있는 세 가지 방법이 있습니다. 직접 및 역 반응, 반응물 및 생성물의 농도를 시각. 각 사례를 살펴 보겠습니다.
첫 번째 경우: 동일한 농도 :
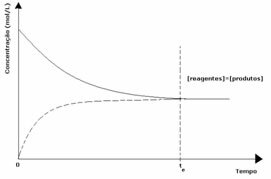
그래프에서 볼 수 있듯이 시간 t에서과 순방향 및 역방향 반응이 동일하며, 이 경우 반응물과 생성물의 농도가 동일합니다. 따라서 균형은 양쪽으로 이동하지 않으며 두 반응의 강도는 아래와 같이 동일합니다.
두 번째 경우: 제품 농도보다 높은 시약 농도 :
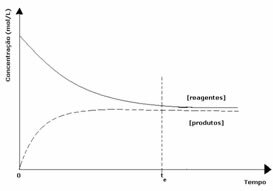
이 경우 평형에 도달하면 반응물의 농도가 생성물의 농도보다 큰 것으로 관찰됩니다. 따라서 반응물이 많을수록 역반응이 더 강하게 발생하는 것으로 판단된다. 반응이 왼쪽으로 이동합니다.
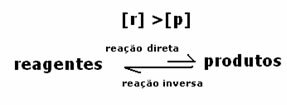
세 번째 경우: 시약보다 더 많은 제품의 농도 :
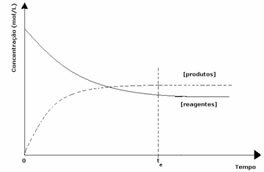
평형 상태에서 생성물의 농도가 더 크므로 이것은 반응이 직접 반응 (제품 형성과 함께)이 더 많이 발생하기 때문에 오른쪽으로 이동 강렬.
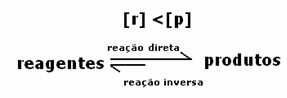
반응이 오른쪽 또는 왼쪽으로 진행되는지 여부를 나타내는 것은 온도에만 의존하는 평형 상수 K입니다.
작성자: Jennifer Fogaça
화학 전공
브라질 학교 팀
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm

