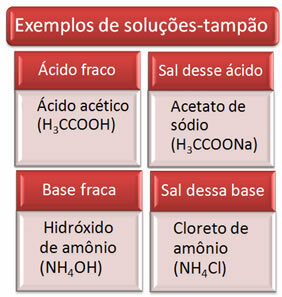
완충 용액은 일반적으로 약산과 그 산의 염 또는 약염기와 그 염기의 염의 혼합물입니다. 이 솔루션은 용액의 pH 또는 pOH에서 매우 큰 변화가 발생하는 것을 방지하기위한 것입니다.
다음은 버퍼 솔루션의 몇 가지 예입니다.
완충액의 효과는 우리 혈액에서 볼 수 있으며, 혈장에 소량의 산이나 염기를 첨가하더라도 pH에는 거의 변화가 없습니다.
물에 산이나 염기를 첨가하면 pH가 빠르게 변한다는 점을 감안할 때 어떻게 이런 일이 발생합니까?
인간의 혈액은 약간 기본적인 완충 시스템입니다. 즉, 완충액입니다. pH는 7.35에서 7.45 사이에서 일정하게 유지됩니다. 혈액에서 가장 흥미롭고 중요한 완충액 중 하나는 탄산 (H2CO3) 및이 산의 염, 중탄산 나트륨 (NaHCO3).
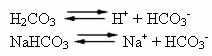
따라서이 완충액에는 다음과 같은 종류가 있습니다.
H2CO3: 약산이므로 다량 존재하며 이온화가 적다.
H+: H의 이온화에서2CO3;
HCO3-: H의 이온화로 인해 다량으로 존재2CO3 및 염 해리 (NaHCO3);
에서+: NaHCO의 이온화에서3;
이 용액에 소량의 산을 첨가하면 이온화가 일어나 H 양이온이 생성됩니다.+, HCO 음이온과 반응합니다.3- 매체에 존재하며 비 이온화 탄산에서 유래합니다. pH에는 변화가 없습니다.
염기가 추가되면 OH 음이온이 생성됩니다.-. 이 이온은 H 양이온과 결합합니다.+, H의 이온화에서2CO3. 따라서 OH 음이온은- 중화되어 배지의 pH를 유지합니다.
언급 된이 완충 용액 외에도 혈액에 다음과 같은 두 가지 다른 용액이 존재합니다. H2먼지4/HPO42- 그리고 일부 단백질. 혈액에 그러한 완충액이 없다면 pH 범위가 심각하게 왜곡 될 수 있습니다. 혈액 pH가 7.8 이상으로 상승하면 알칼리증이라고합니다. pH가 6.8 이하로 너무 많이 떨어지면 산증 상태가됩니다. 둘 다 사망으로 이어질 수있는 위험한 상태입니다.

작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm