보통의 반응 수성 전기 분해 과 화성 전기 분해 그들은 반응에 참여하지 않는 흑연 및 백금 전극으로 수행됩니다. 그들은 전류 만 전도합니다. 그러나 사용이 필요한 특정 경우가 있습니다. 활성 전극즉, 환원과 산화를 겪습니다.
산화 환원 공정에 참여하는 이러한 전극의 주요 사용 사례는 다음과 같습니다. 전해 금속 정화, 예컨대 아연, 코발트, 니켈 및 특히 구리; 그리고 또한 전기 도금. 각 사례가 어떻게 발생하는지 살펴 보겠습니다.
• 구리 전해 정제:이 전해동 정제는 약 99.9 %의 순도를 생산할 수 있으며 주로 불순물이 가장 적을 경우 매우 전류를 전도 할 수있는 구리선 감소했습니다.
아래에 조립 된 전해조의 개략도를보고이 과정이 어떻게 이루어지는 지 관찰하십시오.

황산구리 수용액 (CuSo4 (수성)) – 전기를 전도하여 불순한 금속 구리 인 양극이 전자를 잃게됩니다. 즉, 산화를 거쳐 양이온 (Cu2+), 네거티브 플레이트에 증착됩니다. 이것은 불활성 백금 판이거나 더 나은 순동 판일 수 있습니다. 그것은 구리가 증착됨에 따라 감소되는 음극을 구성합니다. 따라서 전극에서 발생하는 반 반응은 다음과 같습니다.
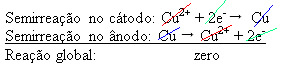
결과가 0이라는 사실은 화학 반응이 없었고 구리의 수송 만 있음을 나타냅니다. 용기의 바닥에는 금, 은, 실리카 (모래) 및 기타 광물과 같이 구리에 포함 된 다른 불순물이 있으며 판매도 가능합니다.
• 전기 도금: 부식으로부터 보호되어야하는 재료에 금속 코팅이 적용됩니다.
코팅을 위해 선택된 금속-크롬 (크롬 도금), 니켈 (니켈 도금),은 (은 도금), 금 (금 도금) 또는 아연 (아연 도금) – 양극, 양극이되어 산화를 거쳐 전자를 잃게됩니다. 환원 가능성이 더 크기 때문에 보호 된 재료 대신 산화를 겪습니다.
이러한 전자를 받아 환원을 겪는 음극, 즉 음극은 코팅 된 물질 자체입니다. 이런 식으로 표면이 어떻게 든 훼손 되더라도 보호 상태를 유지합니다.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/eletrolise-com-eletrodos-ativos.htm
