가역 반응은 일반적으로 일정량의 시약으로 시작됩니다. 직접 반응이 시작되면 시간이 지남에 따라 이러한 시약이 형성에 소비됩니다. 결과적으로 시약의 농도는 감소하는 반면 제품의 농도는 증가합니다. 그런 다음 역반응이 시작되어 직접 반응과 역반응의 발생 속도 (속도)가 동일하게 유지되어 소위 화학적 균형.
평형에서는 평형 상수 Kc가 있으며 기본적으로 다음과 같이 표현됩니다.
|
Kc = [제품]균형 화학 방정식의 계수 [시약]균형 화학 방정식의 계수 |
즉, 다음과 같은 일반적인 평형 반응을 고려합니다.
a A + b B ↔ c C + d D
소문자가 계수이고 대문자가 물질이므로이 반응의 평형 상수는 다음과 같습니다.
Kc = [씨]씨. [디]디
[그만큼]그만큼. [비]비
이에 대한 자세한 내용은 텍스트에서 볼 수 있습니다. Kc 및 Kp 평형 상수. 이 텍스트는 또한 중요한 것을 보여줍니다. Kc 값은 시약의 농도와 제품이 같거나 하나가 다른 제품보다 크거나 결과적으로 화학 균형이 어떤 방향으로 이동하는 경우 반응.
그래서 우리는 Kc의 값을 결정해야합니다. 이를 위해이 계산은 실험적이므로 반응의 몇 가지 예와 그로부터 얻은 데이터를 살펴 보겠습니다.
이러한 계산을 수행하는 데 매우 도움이되는 것은 아래 표시된 것과 유사한 테이블을 작성하고 여기에 언급 된 단계를 따르는 것입니다.

평형 상수를 계산하는 데 사용되는 데이터를 구성하는 표
이제 연습하러 갑시다.
예 1 : 2L 용량의 밀폐 된 용기에 100 ° C의 온도에서 20 mol의 N2영형4. 다음과 같은 가역 반응이 발생하기 시작합니다. N2영형4 ↔ 아니오2. 얼마 후, 반응이 화학적 평형에 도달하고 8 mol의 NO2 형성되었다. 100 ° C의 온도에서 평형 상수 Kc의 값은 얼마입니까?
해결:
테이블을 사용합시다.

평형 상수 계산 예
반응하고 형성하는 양이 쓰여진 줄에서 우리는 4 몰의 N이 소비되었다는 것을 알고 있습니다.2영형4왜냐하면 비율이 1: 2이고 8 mol의 NO가 형성 되었기 때문입니다.2.
이제이 반응의 평형 상수 Kc 표현에서 찾은 값을 대체하십시오.
Kc = [에서2]2
[엔2영형4]
Kc = (4 몰 / L) 2
(8 몰 / L)
Kc = 2 mol / L
Kc의 값은 차원이 없으며 크기와 관련된 단위가 없습니다.
이제 처음부터 제품이 포함 된 예를 살펴 보겠습니다.
예 2 : 5L 용량의 밀폐 된 용기에는 온도 T에서 2 몰의 수소 가스, 3 몰의 요오드 가스 및 4 몰의 요오드화 수소가 있습니다. 반응은 온도 T에서 화학적 평형에 들어가고 용기에 1 몰의 수소 가스가 있음이 밝혀졌습니다. 이 평형을 나타내는 그래프는 무엇이며 T 온도에서 평형 상수 Kc의 값은 얼마입니까?
해결:
테이블 사용 :
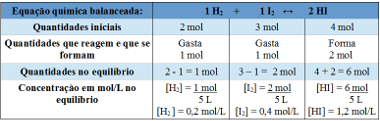
평형 상수를 결정하는 데 사용되는 표
평형에 도달 할 때까지 시약 및 제품의 mol / L 농도 변화를 보여주는 그래프는 다음과 같이 나타낼 수 있습니다.

시약 및 제품의 농도 변화를 보여주는 화학적 평형 그래프
이제 우리는 평형 상수의 값을 발견합니다.
Kc = __ [HI]2__
[H2 ]. [나는2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm

