아래의 일반적인 가역 반응을 고려하십시오. 여기서 소문자는 균형 잡힌 반응 계수에 해당하고 대문자는 반응물이며 생성물은 모두 기체입니다.

각 반응 방향을 개별적으로 고려할 때 발생률 (Td)은 다음과 같습니다.
* 직접 반응: aA + bB → cC + dD
모두곧장 = K곧장. [그만큼]그만큼. [비]비
* 역반응: cC + dD → aA + bB
모두역 = K역전. [씨]씨. [디]디
물질의 양에서 농도에 대한 화학적 평형 상수 (K씨) 및 분압 (K피) K를 나누어 주어집니다.곧장 작성자 K역전.
그래서 우리는 :
케이곧장. [그만큼]그만큼. [비]비 = 1 → 케이곧장__ = __[씨]씨. [디]디___
케이역전. [씨]씨. [디]디 케이역전 [그만큼]그만큼. [비]비
존재, K씨 =_케이곧장_
케이역전
그래서 우리는:
케이씨 =__[씨]씨. [디]디___ 또는 K피 =__(프라 사)씨. (pD)디___ |
여기서 p는 평형 상태에서 각 물질의 분압입니다.
이런 식으로 각 농도는 반응에서 각 물질의 계수에 해당하는 지수로 증가하고 K씨 단위가 없습니다 *.
또한 강조해야 할 매우 중요한 측면은이 표현에서고체 성분이나 순수한 액체는 표시되어서는 안됩니다., 변이를 겪을 수있는 문제 만이 표현에 참여합니다. 고체 상태에서 물질의 양의 농도는 일정하므로 이미 K 자체의 값에 포함되어 있습니다.씨. 물과 같은 순수한 액체도 마찬가지입니다. 요컨대, 기체 상태와 수용액 상태의 물질 만 표현에 참여합니다.
아래 예를 참고하십시오.
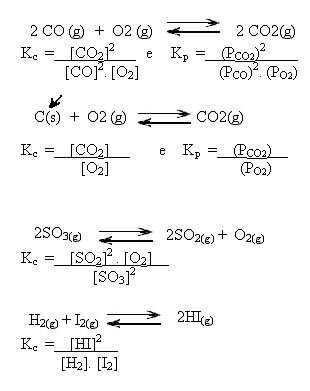
K 값씨 반응물과 생성물의 농도가 같거나 하나가 다른 것보다 더 큰지 보여줄 수 있습니다.
- 만약 케이씨 또는 K피 1 (K씨 = 1), 이것은 시약 및 제품의 농도가 동일 함을 의미합니다.
- 값이 케이씨 또는 K피 키가 크다, 이것은 제품이 더 높은 농도에 있음을 의미합니다.씨 제품은 분자에 있습니다.
- 값이 케이씨 또는 K피 낮다, 이것은 K의 표현에서 시약이 더 높은 농도에 있음을 의미합니다.씨 시약은 분모에 있습니다.
*케이씨 그리고 K피 그들은 차원이없는 숫자, 즉, 크기 사이의 관계 또는 크기와 관련된 단위가없는 순수한 숫자입니다.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm

