ㅏ 승화 액상을 거치지 않고 고체상에서 기체상으로 직접 이동하는 것을 특징으로 하는 물질의 물리적 상태 변화입니다. 엄밀히 말하면 모든 물질은 승화를 겪을 수 있지만 특정 압력 및 온도 조건 하에서 가능합니다. 승화는 고상에서의 증기압 및 고형물에 의해 가해지는 분자간 상호작용과 상관관계가 있습니다.
이 과정은 고체 이산화탄소로 구성된 드라이아이스 조각에서 쉽게 관찰할 수 있습니다. 이산화탄소는 압력과 실온에서 승화합니다. 승화의 반대 프로세스는 재승화 또는 증착이라고 할 수 있습니다. 승화가 일어나려면 물질이 에너지를 흡수해야 하므로 흡열 과정으로 간주됩니다.
읽기: 물질의 물리적 상태는 무엇입니까?
승화 요약
승화는 액체상을 거치지 않고 고체상에서 기체상으로 직접 이동하는 것입니다.
물질의 승화를 관찰하기 위해서는 특정 압력 및 온도 조건이 필요합니다.
승화는 고체상의 증기압 및 분자간 상호 작용과 같은 열역학적 측면의 영향을 받습니다.
승화는 흡열 과정입니다.
승화의 예는 고체 이산화탄소로 구성된 드라이 아이스에서 발생하는 것입니다.
승화 란 무엇입니까?
승화는 고체상에서 기체상으로 직접 전이, 액상을 거치지 않고. 일부 고체의 경우 특정 온도 및 압력 조건에서 발생합니다. 이 전이는 화학 반응을 수반하지 않는 상태 변화의 물리적 과정입니다.
역과정, 즉 기체상에서 고체상으로 직접 이동하는 과정은 다양하게 불립니다. 일부 저자는 이 위상 변화에 대해 승화라는 단어를 유지하는 반면 다른 저자는 "재승화" 및 심지어 "증착"을 사용합니다.
승화 작동 방식
승화와 증발 사이에 평행선을 그릴 수 있습니다. 두 경우 모두 끝점은 다음과 같습니다. 기상. 차이점은 승화를 위한 고체와 증발을 위한 액체인 시작 단계에 있습니다.
두 경우 모두 압력의 영향이 있다 열과 분자간 상호 작용을 포함하는 증발 및 열역학적 측면.
증기압이란 무엇입니까?
액체를 담고 있는 밀폐된 용기에서 액체상과 증기상 사이에 평형이 있다는 것을 인지하는 것이 가능합니다. 이는 끓는 온도 이하에서도 존재하는 에너지가 액체의 일부 분자가 분리되어 증기로 전달되기에 충분하기 때문에 발생합니다. 그러나 일부 증기 분자는 다시 응축되어 액상으로 돌아갈 수 있으며 이는 공정의 가역성을 보여줍니다.
이 증기는 물질(질량과 부피를 가짐), 운동 액체 표면의 압력, 증기압으로 알려져 있습니다. 액체의 양이 아니라 온도에 따라 달라집니다. 온도가 높을수록 분자가 액상에서 더 쉽게 분리되기 때문입니다.
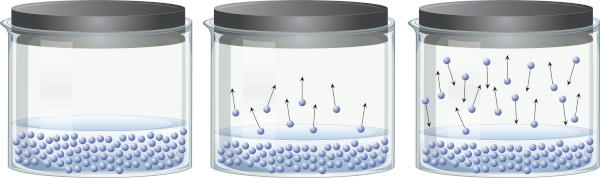
상온에서 증기압이 높은 액체를 휘발성이라고 합니다. 예를 들어, 25°C에서 에틸 에테르의 증기압은 0.58atm, 아세톤(프로파논)의 증기압은 0.29atm, 물의 증기압은 0.023atm입니다. 그런데 증기압이 대기압과 같아지면 액체가 끓는다. 증기압에 대해 자세히 알아보려면 클릭하십시오. 여기.
증기압과 승화
정도는 덜하지만, 고체도 증기압을 갖는다, 그러나 액체보다 훨씬 낮습니다. 예를 들어, 1000K의 온도에서도 철의 증기압은 9.21 x 10-20 ATM. 그러나 요오드와 같은 일부 고체는 승화되어 정상 온도(4 x 10-4 ATM).
이것은 분자가 고체 상태에서 기체 상태로 직접 이동하는 경우에만 가능합니다. 이를 위해서는 고체 분자가 존재해야 합니다. 분자간 상호 작용 약한 (예를 들어 요오드에서는 유도 쌍극자 유도 쌍극자 유형입니다).
또한 승화 과정은 흡열입니다즉, 고체 분자가 분자간 상호 작용을 깨고 증기 상태로 전환할 수 있도록 열의 형태로 에너지를 흡수할 필요가 있습니다. 관련된 열의 양은 승화 엔탈피로 알려진 열역학적 양으로 측정할 수 있습니다.
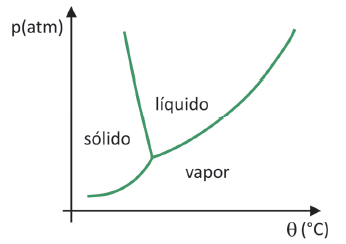
위상 다이어그램
에게 고체의 승화가 일어나는 압력과 온도의 범위를 알기 위해, 위상 다이어그램을 평가해야 합니다. 이산화탄소 CO의 경우를 보자.2.

상 다이어그램에서 상태(고체, 액체 및 기체) 사이의 경계선은 다음에 대한 압력 및 온도 값을 함께 가져옵니다. 상태의 변화가 일어난다. CO2의 경우를 관찰하면 1기압에서 고체상이 -78.5°C의 온도에서 직접 증기상으로 넘어가 승화하는 것을 알 수 있습니다.
이산화탄소는 5.11기압 이상의 압력에서만 액상을 가지며 그 이상의 압력에서는 더 이상 승화가 불가능합니다. 위상 다이어그램에 대해 자세히 알아보려면 다음을 클릭하십시오. 여기.
승화의 예
드라이 아이스: 파티나 행사에서 안개 효과를 내기 위해 자주 사용되는 드라이아이스는 사실 고체 상태의 이산화탄소입니다.

좀약: 좀약은 방향족 유기화합물인 나프탈렌으로 만들어집니다. 그것은 나쁜 냄새를 제거하고 또한 나방, 바퀴벌레 및 기타 독이 있는 동물을 겁주기 위해 적용되며, 이것이 옷장이나 심지어 소변기에 사용되는 것이 일반적인 이유입니다.

장뇌: 장뇌자갈도 독특한 냄새가 나며 승화될 수 있습니다. 그들은 또한 모기를 쫓아내고 곰팡이를 예방하는 역할을 합니다.

요오드: 할로겐에 속하는 비금속도 승화된다.

그러나 제시된 물질 중, 대기 조건에서 이산화탄소만 승화. 다른 것들은 승화하더라도 우리가 살고 있는 압력 하에서 정상적인 융합을 겪을 수 있습니다.
읽기: 플라즈마 — 물질의 네 번째 상태
승화에 해결 연습
질문 1
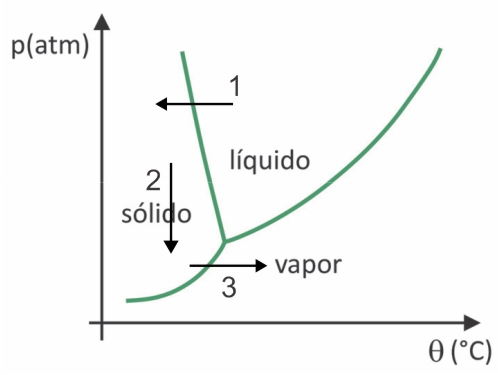
(Fuvest 2020) 슈퍼마켓에서는 과일, 야채, 고기와 같은 소위 동결 건조 식품을 찾는 것이 일반적입니다. 동결 건조 식품은 냉장 보관하지 않아도 오랜 시간이 지난 후에도 여전히 섭취하기에 적합합니다. 이러한 식품에서 "동결 건조"라는 용어는 냉동 과정과 물 승화에 의한 후속 탈수를 의미합니다. 물 승화가 발생하려면 압력-온도 그래프에 표시된 것처럼 조건의 조합이 필요합니다. 여기서 선은 상전이를 나타냅니다.
산업적으로 특정 기술의 사용을 필요로 하는 프로세스임에도 불구하고 사람들이 안데스 산맥의 가장 높은 지역에 살았던 콜럼버스 이전 사람들은 음식을 동결 건조할 수 있었습니다. 더 많은 시간. 자연 동결 건조 과정이 어떻게 발생했는지 설명하는 대안을 확인하십시오.
a) 산의 낮은 기온과 높은 기압으로 인해 물의 승화가 일어났다.
b) 음식은 추운 시기에 자연적으로 얼린 후 승화가 가능한 기압이 낮은 산의 가장 낮은 곳으로 옮겨졌다.
c) 음식은 온도를 높이기 위해 태양에 노출되었고 낮은 국지적 대기압은 응고를 선호했습니다.
d) 추운 시기에 온도는 음식을 얼릴 만큼 충분히 낮았고, 높은 산의 낮은 대기압은 승화를 가능하게 했습니다.
e) 식품은 자연냉동 후 압착하여 압력을 높여 승화가 일어날 수 있도록 하였다.
응답: 문자 D.
동결 건조에서는 후속 승화와 함께 물이 동결됩니다. 콜럼버스 이전의 사람들은 겨울에 물이 얼 수 있는 것처럼 그러한 과정을 수행할 수 있었습니다(화살표 1). 그리고 안데스 산맥의 가장 높은 지역의 낮은 압력(화살표 2)으로 승화(화살표 2)를 겪을 수 있습니다. 3).
질문 2
(Uerj 2005) 냉동 공정에 널리 사용되는 드라이아이스 또는 응고된 이산화탄소는 주변 조건에서 승화됩니다. 이 변환 동안 에너지 변동 현상과 상호 작용의 중단이 발생합니다.
이러한 현상은 각각 다음과 같이 분류됩니다.
a) 발열 - 이온성
b) 발열 - 핵간
c) 등온 - 원자간
d) 흡열 - 분자간
응답: 문자 D.
승화는 고상 분자를 콤팩트하게 유지하는 상호 작용을 방해하기 위해 열을 흡수해야 하기 때문에 흡열 과정입니다. 이러한 상호 작용은 분자간 유형입니다.
스테파노 아라우조 노바이스
화학 교사
