텍스트“촉매 및 촉매”, 촉매는 반응 속도를 가속화하는 화학 종입니다. 그것의 사용은 가능한 한 생산 시간을 절약하려는 화학 산업에서 매우 유용합니다.
그러나 특정 상황에서는 반응이 더 느리게 진행되는 것이 더 흥미 롭습니다. 예를 들어 매우 빠른 반응의 속도를 결정하려는 경우입니다. 이 업적을 달성하고 이러한 반응을 제어하고 연구하려면 반응을 늦추는 물질을 추가하는 것이 일반적입니다. 억제제, 독극물 또는 항 촉매.
이 화학 종은 촉매와 결합하여 작용을 무효화하거나 감소시킵니다. 이는 촉매의 작용 메커니즘이 활성화 에너지를 감소시키고 반응 과정을 촉진하며 속도를 높이기 때문입니다. 이미 억제제는 역으로 작용하여 반응물이 활성화 된 복합체에 도달하는 데 필요한 활성화 에너지를 증가시킵니다.
언급 할 수있는 예로는 비소 (As)가 있는데, 이는 철 (Fe)을 사용하여 암모니아 생산을 위해 산업에서 널리 사용되는 반응 인 하버-보쉬 반응에서 이러한 기능을 가지고 있습니다(에스)) 촉매로. 따라서 철의 효율은 비소의 존재하에 매우 작아 져이를 억제합니다. 즉, 이 반응의 촉매 독이며, 이는 아래와 같습니다.
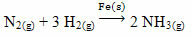
비소는 또한 금속 백금 (Pt)을 사용할 때 반 촉매 작용을 할 수 있습니다.(에스)) SO 연소 반응을위한 촉매2 (g), 삼산화황 (SO3 (g)). 소량이라도 비소의 존재는 생산의 일부를 마비시킬 수있는 백금의 촉매 작용을 상쇄시킵니다. 그렇기 때문에 일반적으로이 생산을 처리하는 산업에서 오산화이 바나듐이 사용됩니다 (V2영형5 (초)) 백금 대신 촉매로.
또 다른 예는 다음과 같은 과산화수소 분해 반응에서 발생합니다.
2 시간2영형2 (수성) → 2 시간2영형(1) + 1O2 (g)
이 경우 사용할 수있는 억제제는 약간의 산성이다. 왜냐하면 매체가 산성 일 때 반응이 더 느리게 진행되기 때문이다.
그러나 억제제는 주로 식품, 음료, 화장품 및 의약품의 자연 분해에 대한 반응 지연 제 역할을하기 위해 업계에서 널리 사용됩니다.
예를 들어 화장품은 소비자에게 도달하는 데 오랜 시간이 걸릴 수 있습니다. 따라서 오 일상에 사용되는 항진균 역할을하는 프로필 파라벤, 수상에 사용되는 살균 효과가있는 메틸 파라벤 등 다양한 방부제가 사용된다. 각각의 구조는 다음과 같습니다.
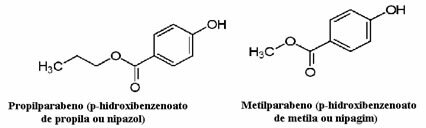
많은 화장품 라벨에“파라벤이 포함되어 있지 않습니다”라는 문구가 있다는 것이 흥미 롭습니다. 즉, 이 화장품에는 우리가 언급 한 이러한 방부제가 없으며 일반적으로 동물 실험을 거치지 않았습니다.
작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/inibidores-catalisador.htm
