영형 단계 다이어그램 온도와 압력을 알면서 주어진 시간에 물질이 어떤 물리적 상태인지 정의 할 수있는 그래프입니다.
실험실 측정은 주어진 물질의 위상 다이어그램을 만드는 데 사용됩니다.
다이어그램은 고체, 액체 및 증기 상태를 나타내는 세 영역으로 나뉩니다.
이 영역을 구분하는 선의 점은 물질이 두 가지 상태에있을 수있는 온도 및 압력 값을 나타냅니다.
위상 다이어그램에는 다음 요소가 있습니다.
- 곡선 퓨전: 고체 상태와 액체 상태에 해당하는 영역을 구분합니다.
- 곡선 증발: 액체 및 증기 단계에 해당하는 영역을 분리합니다.
- 곡선 승화: 고체상과 증기 상에 해당하는 영역을 분리합니다.
- 삼중점: 세 곡선 (융합, 기화 및 승화)의 교차점. 이 점은 물질이 동시에 세 가지 상태에있을 수있는 온도 및 압력 값을 나타냅니다.
- 임계점: 물질이 증기 인 최고 온도를 나타냅니다. 그 시점부터는 더 이상 액체 상태와 증기 상태를 구분할 수 없습니다. 임계점 이상의 온도에서 물질은 가스가됩니다.
아래 그림에서는 위상 다이어그램을 보여줍니다.

자세한 내용은: 물리적 상태 변화.
녹는 곡선
일반적으로 물질은 융합되면 부피가 증가하고 반대로 응고되면 부피가 감소합니다. 결과적으로 압력이 증가하면 융점 (용융 온도)이 증가합니다.
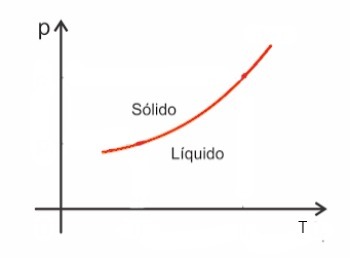
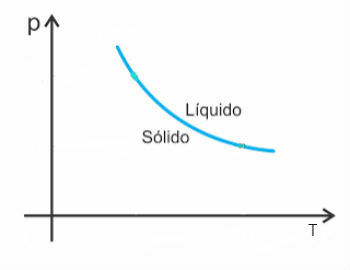
그러나 물 중 일부 예외가 있으며 용융시 부피가 감소합니다. 이 경우 압력이 증가하면 융점이 감소합니다.
따라서 이러한 물질의 용융 곡선은 다음과 같습니다.
예
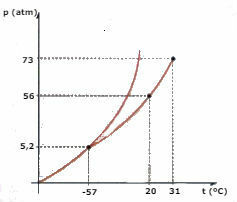
CO 위상 다이어그램 고려2 (이산화탄소) 아래에 나와있는 질문에 답하십시오.
a) CO는 어떤 단계입니까?2 , 온도가 -60 ° C이고 압력이 50 atm 일 때?
b) 일정량의 CO2 액체는 56 기압의 압력을 받고 용기에 갇혀 있습니다. 액체가 가열되어 압력을 일정하게 유지하면 기화가 발생하는 온도 값은 얼마입니까?
c) CO의 삼중점 온도와 압력 값은 얼마입니까?2?
d) 드라이 아이스 (CO2)는 2 기압의 압력을받습니다. 일정한 압력을 유지하면서 가열됩니다. 특정 순간에 위상 변화가 발생하기 시작합니다. 이 변경의 이름은 무엇입니까?
해결:
a) 다이어그램을 관찰하면 CO가2 고체 상태 일 것입니다.
b) 온도가 20 ° C에 도달하면 기화가 발생합니다.
c) 삼중점은 CO의 경우 세 곡선의 교차점에 해당합니다.2, 온도가 -57 ° C이고 압력이 5.2 atm 일 때 세 가지 물리적 상태가 공존 할 수 있습니다.
d) 승화가 발생합니다
자세한 내용은 다음을 참조하십시오.
- 응고
- 녹는 점과 끓는점
- 증발
- 응축
해결 된 연습
1) 에넴-2000
오늘날에도 사람들은 환경보다 낮은 온도에서 물을 절약하기 위해 토기 용기 (항아리 또는 초벌구이 세라믹 냄비)를 사용하는 것이 매우 일반적입니다. 이 때문입니다:
a) 점토는 환경에서 물을 분리하여 마치 스티로폼처럼 항상 자체 온도보다 낮은 온도로 유지합니다.
b) 점토는 화학 성분으로 인해 물을 "동결"시키는 힘이 있습니다. 반응에서 물은 열을 잃습니다.
c) 점토는 다공성이므로 물이 통과 할 수 있습니다. 이 물의 일부가 증발하여 모 링가와 나머지 물에서 열을 받아 냉각됩니다.
d) 점토는 다공성이므로 물이 주전자 외부에 가라 앉을 수 있습니다. 외부 물은 항상 내부보다 높은 온도입니다.
e) 모링가는 자연적으로 물의 온도를 낮추는 흡습성 물질을 방출하는 일종의 천연 냉장고입니다.
대안 c: 점토는 다공성이므로 물이 통과 할 수 있습니다. 이 물의 일부가 증발하여 모 링가와 나머지 물에서 열을 받아 냉각됩니다.
2) Ita-2013 년
다음 그림에 개략적으로 표시된 가상 단계 다이어그램을 고려하십시오.

점 A, B, C, D 및 E는 무엇을 나타 냅니까?
지점 A: 승화 지점
지점 B: 삼중점
C 점: 녹는 점 / 응고점
지점 D: 증발 / 응축 지점
지점 E: 임계점
3) UECE-2009
아래에 표시된 PT 위상 다이어그램을 살펴보십시오. 승화 과정을 거친 물질이 궤적을 따른다는 것은 정확하게 결론을 내릴 수 있습니다.

a) X 또는 Y
b) Y 또는 U
c) U 또는 V
d) T 또는 X
대안 b: Y 또는 U

