
때때로 그것은 일어날 수 있습니다 최소 공식 화합물의 분자식과 같고; 그러나 이것은 항상 사실이 아닙니다.
예를 들어 물에 대한 경험적 또는 최소 공식은 H입니다.2O, 물 분자를 구성하는 요소 사이에 2: 1 비율이 있음을 나타냅니다. 그리고 우연히도 이것은 물의 분자식이기도합니다. 그러나 이것이 항상 발생하는 것은 아니라는 것을 확인하려면 아래 두 가지 예를 살펴보십시오.
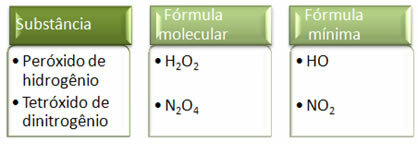
최소 공식은 분자식의 실제 양이 아니라 각 원소의 원자 비율 일 뿐이므로 동일한 실험식을 갖는 서로 다른 화합물의 분자식과 화합물의 최소 공식은 다음의 분자식과 동일 할 수 있습니다. 다른. 아래 예에서 이것이 어떻게 발생할 수 있는지 참고하십시오.
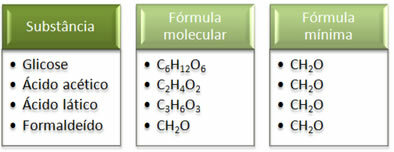
최소 공식 CH2이는 모든 물질에 대해 동일합니다. 즉, 이 최소 공식은 모든 경우에 탄소, 수소 및 산소 원자는 분자식에 다음 비율로 존재합니다. 1:2:1. 더욱이, 실험식과 동일한 분자식을 갖는 유일한 것은 포름 알데히드입니다.
- 최소 또는 경험적 공식의 계산 :
화합물의 실험식을 결정하려면 먼저 그 백분율 또는 근접식이 무엇인지 알아야합니다. 이는 샘플 100g에서 각 원소의 질량을 측정하여 수행 할 수 있습니다. 텍스트 "백분율 또는 센티 멀 공식”이 문제를 더 잘 설명합니다.
예를 들어 주어진 화합물의 근사 조성이 40.00 % C, 6.67 % H 및 53.33 % O로 주어진다고 가정 해 봅시다. 퇴비 샘플 100g의 질량을 고려하여 이러한 값을 그램으로 전달합니다. 따라서 우리는 40g의 C, 6.67g의 H 및 53.33g의 O를 가지고 있습니다.
이제 이러한 값을 물질의 양 (mol)으로 전달할 필요가 있습니다. 우리는 발견 된 각 값을 각각의 몰 질량으로 나누어이를 수행합니다.
C: 40/12 = 3.33
높이: 6.67 / 1 = 6.67
O: 53.33 / 16 = 3.33
값이 정수가 아니기 때문에 다음 장치를 사용합니다. 모든 값을 가장 작은 값으로 나눠서 값 사이의 비율이 변경되지 않도록합니다.
이 경우 가장 작은 값은 3.33이므로 결과는 다음과 같습니다.
C: 3.33 / 3.33 = 1
높이: 6.67 / 3.33 = 2
O: 3.33 / 3.33 = 1
따라서이 알려지지 않은 물질의 최소 공식은 다음과 같습니다. 씨1H2영형1 또는 CH2영형.
간단히 말해서, 물질의 경험적 또는 최소 공식을 찾는 데 필요한 단계는 다음과 같습니다.

작성자: Jennifer Fogaça
화학 전공
출처: 브라질 학교- https://brasilescola.uol.com.br/quimica/formula-minima-ou-empirica.htm
