열역학 제 3 법칙은 엔트로피가 0에 접근하는 물질의 행동을 다룹니다.
이 법칙에 따르면 시스템이 열역학적 평형에있을 때마다 엔트로피가 0에 가까워집니다.
열역학 제 2 법칙은 엔트로피와 관련이 있습니다. 그 후 세 번째 법칙은 엔트로피를 결정하는 절대 기준점을 설정하려는 시도.
Walther Nernst (1864-1941)는 열역학 제 3 법칙의 기초를 형성 한 원리를 다루는 물리학 자였습니다.
Nernst에 따르면, 순수한 물질의 온도가 절대 영도와 같거나 거의 0에 근접하면 엔트로피는 최소값을 갖는 경향이 있습니다.
이를 위해 Nernst는 엔트로피 (ΔS) 및 온도 (T)의 변동이 최소값 인 0 인 경향이 있음을 보여주는 아래 공식을 제안했습니다.
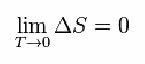
그러나 엔트로피는 무엇입니까?
엔트로피 분자가 시스템에서 스스로를 구성하는 방식입니다. 이 조직은 혼란의 의미가 아니라 분자의 움직임과 동요의 의미에서 무질서로 해석됩니다.
더 많은 분자가 움직일수록 더 많이 무질서 화되고 더 많은 엔트로피가 있습니다.
처음에 Nernst는 그가 제안한 엔트로피가 완벽한 결정에서만 가능할 것이라고 제안했습니다.
마지막으로 그는 절대 영도에 해당하는 온도가 존재하지 않는다는 결론을 내렸고, 이는 세 번째 법칙을 논란의 여지가있는 법칙으로 만듭니다.
그래서 많은 물리학 자들에게 이것은 법이 아니라 규칙입니다.
수년이 지난 후 (1912 년 이후) 과학자들은 절대 영도에 가까워지는이 온도 또는 온도를 얻으려고 노력하고 있습니다. 따라서 그들은 고체 또는 액체 상태의 물질을 버리고 가스에서만 가능하다는 것을 발견했습니다.
읽기 :
- 열역학 제로 법칙
- 열역학 제 1 법칙
- 열역학 제 2 법칙
- 열역학 연습