전기 분해는 비 자발적인 화학 반응 전류에 의해 발생하는 산화-환원 반응을 포함합니다.
전기 분해가 일어나려면 관련된 전류가 지속적이고 충분한 전압을 가져야합니다.
관련 이온이 수행하는 움직임에 자유를 가지려면 융합 (화성 전기 분해) 또는 용해 (용액 내 전기 분해)에 의해 전기 분해가 발생할 수 있습니다.
전기 분해 응용
많은 재료와 화합물이 전기 분해 공정에서 생성됩니다. 예를 들면 다음과 같습니다.
- 알루미늄 및 구리
- 수소 과 염소 실린더에서
- 의상 보석 (아연 도금 공정)
- 압력솥
- 마그네슘 휠 (자동차 휠캡).
전기 분해 법칙
전기 분해 법칙은 영국의 물리학 자이자 화학자 인 Michael de Faraday (1791-1867)에 의해 개발되었습니다. 두 법칙 모두 전기 분해의 양적 측면을 지배합니다.
그만큼 전기 분해의 제 1 법칙 다음과 같은 진술이 있습니다.
“전기 분해 과정에서 증착되는 원소의 질량은 전해 전지를 통과하는 전기의 양에 정비례합니다.”.
Q = i. 티
어디,
큐: 전하 (C)
나는: 전류 강도 (A)
티: 전류가 흐르는 시간 간격 (s)
그만큼 전기 분해의 제 2 법칙 다음과 같은 진술이 있습니다.
“전기 분해 중에 같은 양의 전기로 증착 될 때 다양한 원소의 질량은 화학적 등가물에 정비례합니다”.
M = K. 과
어디,
미디엄: 물질 질량
케이: 비례 상수
과: 물질의 그램 당량
기사에서 자세히 알아보십시오. 패러데이 상수.
분류
전기 분해 과정은 용융 또는 용해를 통해 발생할 수 있습니다.
화성 전기 분해
화성 전기 분해는 용융 된 전해질에서 처리되는 것입니다. 퓨전.
예를 들어 NaCl (Sodium Chloride)를 사용합니다. 물질을 808 ° C로 가열하면 융합되고 이온이 존재합니다 (Na+ 및 Cl-) 이제 액체 상태에서 이동의 자유가 더 커졌습니다.
때 전류 전해조로 전달되는 Na 양이온+ 그들은 음극이라고 불리는 음극에 끌립니다. 이미 Cl의 음이온-, 양극 또는 양극에 끌립니다.
Na의 경우+ 환원 반응이 일어나는 동안 Cl-, 반응이 산화.
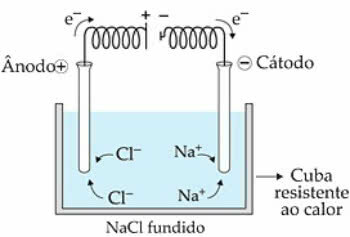
화성 NaCl 전기 분해 계획
수성 전기 분해
수성 전기 분해에서 사용되는 이온화 용매는 물입니다. 수용액에서 전기 분해는 역전극 또는 활성 (또는 반응성) 전극으로 수행 할 수 있습니다.
불활성 전극: 용액의 물은 다음 방정식에 따라 이온화됩니다.
H2O ↔ H+ + 오-
와 더불어 분리 NaCl의 우리는 :
NaCl → Na+ + Cl-
따라서 H 양이온+ 그리고+ OH 음이온은 음극에서 방전 될 수 있습니다.- 및 Cl- 양극에서 방전 될 수 있습니다.
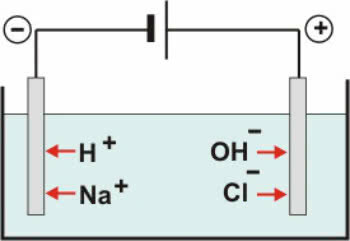
NaCl 수성 전기 분해 방식
양이온에는 환원 반응 (음극 환원)이 있고 음이온에서는 산화 반응 (양극 산화)이 있습니다.
그래서 우리는 전기 분해 반응이 있습니다 :
2 NaCl + 2 H2O → 2에서+ + 2 개 OH- + H2 + Cl2
이것으로부터 우리는 NaOH 분자가 용액에 남아있는 반면 H2 음극과 Cl에서 방출2, 양극에.
이 프로세스는 등가 방정식을 생성합니다.
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
활성 전극:이 경우 활성 전극이 전기 분해에 참여하지만 부식이 발생합니다.
예를 들어, 황산구리 수용액 (CuSO4):
CUSO4 → Cu2 + OS 2-4
H2O → H+ + 오-
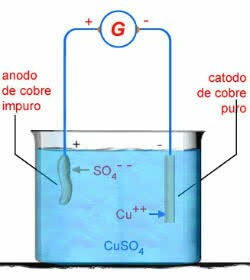 CuSO 수성 전기 분해 체계4
CuSO 수성 전기 분해 체계4
이 경우 구리 양극이 부식됩니다.
나귀0 → Cu2+ + 2e-
이는 전극의 표준 전위에 따라 전류가 Cu에서 전자를 제거하는 데 더 용이하기 때문입니다.0 OS보다 2-4 또는 오에서-.
따라서 음극에서 다음과 같은 전기 분해 반응이 발생합니다.
2e- + Cu2+ → Cu
양극에는 전기 분해 반응이 있습니다.
Cu → Cu2+ + 2e-
마지막으로 두 개의 전기 분해 방정식을 더하면 결과적으로 0이됩니다.
주제에 대해 더 알고 싶으십니까? 기사 읽기 :
- 이온, 양이온 및 음이온
- 화학 반응
- 산화 반응
배터리 및 전기 분해
전기 분해는 배터리의 역 현상을 기반으로합니다. 전기 분해에서 프로세스는 배터리에서 발생하는 것처럼 자발적이지 않습니다. 즉, 전기 분해는 전기 에너지를 화학 에너지로 변환하고 세포는 화학 에너지에서 전기 에너지를 생성합니다.
더 많이 알다 전기 화학.
수업 과정
1. (Ulbra-RS) 금속성 칼륨은 염화칼륨의 화성 전기 분해에 의해 생성 될 수 있습니다. 그 진술에서 올바른 대안을 선택하십시오.
a) 전기 분해는 전류에 의한 산화 환원 및 환원 반응을 포함하는 공정입니다.
b) 염화칼륨의 화성 전기 분해는 실온에서 발생합니다.
c) 칼륨은 자연에서 환원 된 형태 (K0).
d) 전기 분해 반응은 자외선의 도움으로 일어나는 반응입니다.
e) 염화 칼륨의 전기 분해 과정에서 금속 칼륨을 얻기 위해 칼륨에서 염소로의 전자 이동이 발생합니다.
에 대한 대안
2. (UFRGS-RS) 전기 분해 전지의 음극에는 항상 다음이 있습니다.
a) 금속 증착.
b) 감소 반 반응.
c) 전류 생성.
d) 수소 가스 방출.
e) 화학적 부식.
대안 b
3. (Unifor-CE) 전기 분해와 관련된 제안은 다음과 같습니다.
나는. 전기 분해 반응은 전기 에너지 소비와 함께 발생합니다.
II. 포도당 수용액은 전류를 전도하지 않기 때문에 전기 분해 될 수 없습니다.
III. 염수 용액의 전기 분해에서 금속 양이온은 산화됩니다.
우리는 다음과 같이 말할 수 있습니다.
a) 나는 맞다.
b) II가 맞습니다.
c) III이 맞습니다.
d) I와 II가 맞습니다.
e) II와 III가 맞습니다.
대안
4. (FEI-SP) 두 명의 화학 학생이 BaCl 전기 분해를 수행했습니다.2; 첫 번째 물과 두 번째 불. 결과와 관련하여 우리는 둘 다 다음을 얻었다 고 말할 수 있습니다.
a) H2 그건2 양극에서.
b) H2 양극에서 Ba.
c) Cl2 전극에 Ba.
d) H2 음극에서.
e) Cl2 양극에서.
대안 및
5. (Vunesp) "화학없는 풀”는 수처리 관련 광고입니다. 그러나 처리는 물에 염화나트륨을 첨가하고 이것을 통과시키는 것으로 구성됩니다. 납에 연결된 구리 및 백금 전극이 장착 된 용기를 통한 물 차.
a)이 정보를 바탕으로 광고 메시지가 올바른지 논의합니다.
b) 불활성 전극을 고려하여 이전 답변을 정당화하는 관련 반응 방정식을 작성하십시오.
a) 화학 제품이 형성되므로 광고 메시지가 올바르지 않습니다.
b) 2 NaCl + 2H2O → 2 NaOH + H2 + Cl2 (염소를 형성하는 반응, 수영장 물 처리에 유용함)
2 NaOH + Cl2 → NaCl + NaClO + H2O (강한 살균제 인 NaClO를 형성하는 반응)