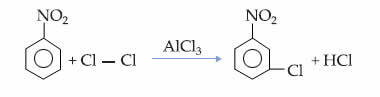
그만큼 옥텟 이론 연구에서 원자 상호 작용이 일어나는 것을 관찰 한 Newton Lewis가 제안했습니다. 각 원소가 희가스의 전자적 안정성을 얻도록즉, 8 개의 전자가 원자가 층. 그러나 일부 분자에서는 옥텟의 확장 또는 축소라고하는 현상이 발생합니다. 즉, 중심 원자가 어느 정도 예측 된 결합을 설정합니다.
읽기: 공유 결합-분류 및 특성
옥텟 이론은 어떻게 작동합니까?
물론 모든 시스템은 최대한 안정을 얻다, 그리고 이것은 원자와 다르지 않습니다. 원자는 모든 물질의 "기본 입자"이며 각각의 구조에 전자 권이 있습니다. 이 전기 권은 리누스 폴링 에너지 수준과 하위 수준에서. Pauling은 원자핵 주변의 전자 분포가 어떻게 생겼는지 보여주는 다이어그램을 개발했습니다.
아래 이미지를 참조하십시오.

각 레벨과 하위 레벨은 전자. 비유하자면 각 레벨은 선반이고 각 하위 레벨은 상자라고 말할 수 있습니다. 각 상자에 두 개의 전자를 맞 춥니 다. 원자는 모든 전자가 쌍을 이룰 때, 즉 각각 두 개의 전자가있는 모든 상자가있을 때 안정합니다.
예:
자연 상태에서 8 개의 전자를 가진 산소 (O)의 전자 분포를 해봅시다.

원자가 레이어 (p 하위 수준의 L 레이어)에서 두 개의 비쌍 전자. 다른 원소와 화학 결합을하는 것은이 전자들입니다 전자 쌍 형성을 찾고.
옥텟 이론은 전자의 합산 수학을 기반으로합니다. 마지막 전자 껍질의 모든 하위 수준에 각각 두 개의 전자가 있으면 원자가 껍질은 총 8 개의 전자를 갖게되며 결과적으로 원자는 안정적입니다.
읽기: 양자 수-전자의 에너지 양과 관련된 숫자
지금 멈추지 마세요... 광고 후 더 있습니다;)
고귀한 가스
비활성 기체는 자연에서 단일 원자 형태로 발견 될 수있다즉, 다른 원자와 결합을 설정하지 않습니다. 전자 안정성이 특징이기 때문입니다. 거의 모두 원자가 껍질에 8 개의 전자가 있습니다., 전자가 두 개 뿐인 헬륨 가스를 제외하고 옥텟 규칙을 따릅니다.

옥텟 이론의 예외
일부 화합물은 원자가 껍질에서 8 개 이하의 전자로 안정화됩니다. 이 경우 옥텟 이론에 대한 예외가 발생합니다.
옥텟 확장
주로 인 (P)과 황 (S)에서 발생하며 상대적으로 큰 원자이며 "d"하위 수준을가집니다. 이 경우 원자는 마지막 껍질에 8 개 이상의 전자를 보유하고 있습니다.
예:

육 불화 황의 경우 중심 요소는 12 개의 전자, 옥텟 규칙에 따라 안정화에 필요한 8을 초과합니다. 이 경우 옥텟이 확장되었습니다.
옥텟 수축
베릴륨 (Be), 붕소 (B) 및 일부 산화물 질소의. 예를 참조하십시오.

삼 불화 붕소의 경우, 불소 원자는 공유를 통해 원자가 껍질에서 필요한 8 개의 전자를 획득합니다. 붕소와 전자, 옥텟 규칙을 따르지만 중심 원자 (붕소)는 6 개의 전자로 안정화되지 않아 발생 하나 옥텟의 수축.
또한 액세스: 시그마 링크의 분류: 기준은 무엇입니까?
해결 된 운동
질문 1 -(Mackenzie-SP) 황 및 칼륨 원자가 희가스와 동일한 전자 구성을 획득하려면 다음이 필요합니다.
(데이터: 원자 번호 S = 16; K = 19.)
A) 황은 2 개의 전자를 받고 칼륨은 7 개의 전자를받습니다.
B) 황은 6 개의 전자를, 칼륨은 7 개의 전자를받습니다.
C) 황은 2 개의 전자를 생성하고 칼륨은 1 개의 전자를 생성합니다.
D) 황은 6 개의 전자를 받고 칼륨은 1 개의 전자를 제공합니다.
E) 황은 2 개의 전자를 받고 칼륨은 1 개의 전자를 제공합니다.
해결
대안 E. 유황은 16 열 또는 6A 계열의 원소입니다. 이 계열의 요소는 전자 쌍을 형성하기 위해 두 개의 전자를받는 경향이 있으며 원자가 쉘에 총 8 개의 전자를 가지고 있습니다. 알칼리 금속 인 1A 계열의 원소는 원자가 껍질에 단 하나의 전자 만 가지고 있습니다. 이 전자를 기증함으로써 이전 층은 옥텟 규칙에 따라 이미 8 개의 전자가있는 원자가 층이됩니다.
질문 2- 다음 진술을 참 (T) 또는 거짓 (F)으로 판단하십시오.
I () 옥텟 법칙은 원자가 안정되기 위해서는 원자가 껍질에 8 개의 전자가 필요하다고 말합니다.
II () 원자가 층은 원자의 두 번째 전자 층입니다.
III () 할로겐 계열의 염소 (Cl)는 안정성을 얻기 위해 두 개의 전자를 얻는 경향이 있습니다.
IV () 1A 계열의 원소 인 나트륨 (Na)은 원자가 껍질에서 유일한 전자를 잃는 경향이 있습니다.
올바른 대안을 표시하십시오.
A) I, III 및 IV는 사실입니다.
B) I와 IV는 사실입니다.
C) 오직 II 만 사실입니다.
D) IV 만 거짓입니다.
E) 모두 사실입니다.
해결
대안 B. I와 IV는 사실입니다. 원자가 층이 두 번째가 아니라 원자의 마지막 전자 층이기 때문에 진술 II는 올바르지 않습니다. 그리고 성명 III에 따르면 염소는 두 개의 전자를 얻는 경향이 있는데, 이는 염소가 7A 또는 17 군은 전자를 하나만 획득하여 가스의 전자 구성을 획득하는 경향이 있습니다. 고귀한.
작성자: Laysa Bernardes Marques de Araújo
화학 교사