가스와 증기
가스와 증기의 차이는 임계 온도에서 제공됩니다. 증기는 기체 상태의 물질로 압력이 증가함에 따라 액화 될 수 있습니다. 가스는 동일하지 않습니다. 단순한 압력 상승으로는 액화 할 수없는 액체입니다. 이것은 가스를 증기와 다르게 만듭니다.
가스의 거동
기체 상태의 주어진 물질은 온도가 임계 온도보다 높으면 기체이고, 온도가 임계 온도보다 낮거나 같으면 물질은 증기입니다.
헬륨, 질소 및 산소와 같이 우리가 일반적으로 알고있는 실제 가스는 각각 다른 특정 분자 특성을 가지고 있습니다. 그러나 우리가 그것들을 모두 고온과 저압에 놓으면 매우 유사한 행동을 보이기 시작합니다. 기체 연구에서 실제 기체와 유사한 거동을 가진 단순한 이론적 모델이 채택되었습니다. 이 근사치는 압력이 낮을수록 온도가 높아집니다. 이 가스 모델은 완벽한 가스.
17 세기와 19 세기 경 세 명의 과학자 (Jacques Charles, Louis J. Gay-Lussac과 Paul E. Clayperon)은 기체의 거동을 연구 한 후 이상 기체라고도 불리는 완벽한 기체의 거동을 관장하는 법칙을 정교화했습니다. 그들에 의해 결정된 법칙은 완벽한 가스의 "외부"행동 규칙을 설정하여 볼륨, 온도 및 다음과 같은 관련 물리량 만 계산합니다. 압력.
완벽한 기체의 일반 법칙
완벽한 기체의 일반 법칙을 결정하는 표현은 다음과 같이 볼 수 있습니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
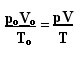
어디 p영형, V영형 그리고 T영형 각각 초기 압력, 초기 부피 및 초기 온도입니다. 이것은 가스의 변수가 변할 때 사용되는 표현입니다.
보일의 법칙
물리학 자이자 화학자 인 로버트 보일 (Robert Boyle)은 온도가 일정하게 유지 될 때 가스가 겪는 변형을 지배하는 법칙을 결정한 사람입니다. 그의 법칙에 따르면 가스가 등온 변형을 겪을 때 그 압력은 점유 된 부피에 반비례합니다. 이 법칙에서 우리는 어떻게 티영형 = T 우리는 :
피영형V영형 = pV
Charles의 법칙
Charles의 법칙은 완벽한 기체를 일정한 부피로 변환하는 법칙입니다. 이러한 변환을 등각 변환 또는 등각 변환이라고합니다. 이 법칙에 따르면 완벽한 기체 질량이 등 코릭 변환을 겪을 때 그 압력은 절대 온도에 정비례합니다. 수학적으로이 법칙은 다음과 같이 표현할 수 있습니다.

어디 p영형 그리고 T영형 이들은 각각 초기 압력과 초기 온도입니다.
Gay-Lussac의 법칙
Gay-Lussac의 법칙은 일정한 압력에서 완벽한 기체의 변형을 제어하는 법칙입니다. 이 법칙은 Gay-Lussac이라는 이름을 가지고 있음에도 불구하고 물리학 자이자 화학자 인 A.C. Charles에 의해 이미 발견되었습니다. 법칙에 따르면 기체가 등압 변환을 겪을 때 기체의 부피는 절대 온도에 정비례합니다. 수학적으로이 법칙은 다음과 같이 표현할 수 있습니다.

어디 V영형 그리고 T영형 각각 초기 부피와 초기 온도에 해당합니다.
작성자: Marco Aurélio da Silva
더보기!!
가스 변환
가스 변환이 무엇인지 아십시오.
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
SANTOS, Marco Aurélio da Silva. "가스 연구"; 브라질 학교. 가능: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. 2021 년 6 월 27 일 액세스.