에 대한 질문 Enem의 화학적 균형 매우 반복적입니다. 이를 염두에두고이 자료를 만들었습니다.이 자료는 National High School Exam (Enem)에서 다루는이 물리 화학 분야에 대한 가장 중요한 주제를 제공합니다.
화학적 평형과 관련된 문제 중 우리는 농도 (mol / L)와 압력 측면에서 평형 상수를 가지고 있습니다. 이온 평형 상수, 이온화 상수, 평형 이동, pH 및 pOH, 가수 분해 상수, 버퍼 및 상수 용해도.
위에서 설명한 주제 중 일부는 Enem에서 더 두드러집니다.
균형 이동
이온화 상수
pH
식염수 가수 분해
Enem의 화학 균형에 대한 비디오 강의
1. Enem의 평형 이동
1.1- (Enem 2015) 저산소증 또는 신장병은 산소 감소 (O2) 신체의 동맥혈에서. 이러한 이유로 많은 운동 선수들이 높은 고도에서 신체 활동을 할 때 불편 함 (두통, 현기증, 숨가쁨)을 경험합니다. 이러한 조건에서 산소화 헤모글로빈 (HbO)의 농도가 감소합니다.2) 관계에 따라 혈액의 균형 :
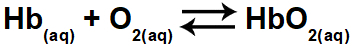
혈액 내 산소화 헤모글로빈 농도의 변화는 다음과 같은 이유로 발생합니다.
a) 혈압 상승.
b) 체온의 상승.
c) 환경의 온도를 낮추십시오.
d) 산소 분압의 강하.
e) 적혈구 양의 감소.
산소화 헤모글로빈 (HbO2)는 방정식의 반응물 (오른쪽)에서 찾을 수 있습니다. 이 운동은 어떤 옵션이 혈액의 산소화 헤모글로빈을 변화시키는 지, 즉 균형을 왼쪽이나 오른쪽으로 이동할 것인지 묻습니다.
a) 거짓. 증가 된 혈류량은 혈압 증가와 관련이 없습니다.
b) 거짓. 온도는 제공된 저울을 변경하지 않습니다.
c) 거짓. 온도는 제공된 저울을 변경하지 않습니다.
d) 맞다. 산소 분압을 낮추면 산소화 헤모글로빈의 양이 감소하여 균형이 왼쪽으로 이동합니다.
e) 거짓. 적혈구 수가 감소하면 헤모글로빈 수와 산소화 헤모글로빈 수가 모두 감소합니다.
1.2- (Enem 2011) 청량 음료는 점점 더 많은 공중 보건 정책의 대상이되었습니다. 접착제 제품에는 치아 매트릭스의 주성분 인 미네랄 인 칼슘 고정에 유해한 물질 인 인산이 포함되어 있습니다. 충치는 치과 탈염 과정에서 산도에 의한 미네랄 손실의 역동적 인 불균형 과정입니다. 치아 법랑질의 주성분은 하이드 록시 아파타이트라고 불리는 염입니다. 수 크로스의 존재에 의해 소다는 생물막 (박테리아 플라크)의 pH를 감소시켜 치아 법랑질의 탈염을 일으 킵니다. 타액 방어 메커니즘은 pH 수준을 정상화하고 치아를 재광 화하는 데 20 분에서 30 분이 걸립니다. 다음 화학 방정식은이 과정을 나타냅니다.

사람이 매일 청량 음료를 섭취한다는 점을 고려할 때 다음 농도의 증가로 인해 치아 탈염 과정이 발생할 수 있습니다.
a) 오-, Ca 이온과 반응2+, 오른쪽으로 균형을 이동합니다.
b) H+, OH 하이드 록 실과 반응-, 오른쪽으로 균형을 이동합니다.
c) 오-, Ca 이온과 반응2+, 균형을 왼쪽으로 이동합니다.
d) H+, OH 하이드 록 실과 반응-, 균형을 왼쪽으로 이동합니다.
e) Ca2+, OH 하이드 록 실과 반응-, 균형을 왼쪽으로 이동합니다.
정답: 문자 B
해결
탈염 과정은 균형을 오른쪽으로 이동합니다. 그 사람이 소다를 마실 때 그들은 산성 물질, 즉 H의 양을 증가시킵니다.+ 중간에. H+ OH와 빠르게 상호 작용- 평형, OH의 양을 감소-. 이런 식으로 균형이 오른쪽으로 이동하여 치아를 탈회합니다.
1.3- (Enem-2013) 수처리 단계 중 하나는 소독이며 염소 처리가 가장 많이 사용되는 방법입니다. 이 방법은 압력 하에서 용액에 염소 가스를 용해하고 소독 할 물에 적용하는 것으로 구성됩니다. 관련된 화학 반응 방정식은 다음과 같습니다.

소독 작용은 차아 염소산 음이온보다 약 80 배 더 큰 소독 잠재력을 가진 차아 염소산에 의해 제어됩니다. 배지의 pH는 하이포 아 염소산이 이온화되는 정도에 영향을 미치기 때문에 중요합니다. 보다 효과적인 소독을 위해서는 처리 할 물의 pH가 다음과 같아야합니다.
a) 0
b) 5
c) 7
d) 9
e) 14
정답: 문자 B
텍스트에 따르면 가장 좋은 소독 작용은 물질 HClO에 의해 수행됩니다. 따라서 모든 해석과 결론은이 물질을 얻는 방법으로 향해야합니다.
물질 HClO는 두 번째 균형에 존재하므로 흥미로운 전략은이 균형을 왼쪽으로 옮기는 것입니다. 이를 위해 Le Chatelier의 원리, 우리는 H의 양을 증가시키는 옵션이 있습니다+ (산성 물질 첨가, pH 7 미만) 또는 Cl 양 증가-.
첫 번째 방정식에서 HClO 종을 나타내는 또 다른 화학적 평형이 있다는 것은 주목할 만합니다.-, H와 친화력이 있습니다.+, 균형을 왼쪽으로 이동합니다. 이것은 우리가 원하지 않는 움직임입니다.
따라서 산성 pH (7 미만)를 사용해야합니다. 그러나이 pH는 많은 H 양이온을 피하기 위해 너무 산성이어서는 안됩니다.+ 중간에.
너무 참조:동굴의 화학적 균형
2. Enem의 pH 및 식염수 가수 분해
2.1- (Enem-2017) 추출 과정을 통해 식물에서 여러 가지 천연물을 얻을 수 있습니다. Lapachol은 나프 토 퀴논 계열입니다. 그 구조는 enol hydroxyl (pKa = 6.0)을 가지고있어 적절한 용액으로 추출한 다음 간단한 여과를 통해이 화합물을 ipe 톱밥에서 분리 할 수 있습니다. pKa = -log Ka이고 Ka가 라파 콜 이온화 반응의 산 상수임을 고려하십시오.

ipê 톱밥에서 라파 콜을 더 효율적으로 추출하려면 어떤 솔루션을 사용해야합니까?
a) Na 용액2CO3 라파 콜 소금을 형성합니다.
b) 아세트산 / 나트륨 아세테이트 완충 용액 (pH = 4.5).
c) 매체의 이온 강도를 높이기위한 NaCl 용액.
d) Na 용액2뿐4 라파 콜과 이온 쌍을 형성합니다.
e) 산-염기 반응을 통해 추출하기위한 HCl 용액.
이 진술은 물질의 pKa가 6.0임을 나타냅니다. 이 pKa 값은 pKa 표현식에서 사용해야합니다.
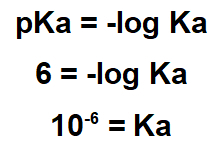
Ka가 작기 때문에 라파 콜은 산성 물질이므로 제거하려면 염기성 물질을 사용하는 것이 좋습니다.
진실. 소금은 강력한 염기 (IA 계열이기 때문에)에서 나오기 때문에 기본이며 CO3 약산 (H2CO3).
b) 거짓. 완충 용액은 산성이며 염기가 필요합니다.
c) 거짓. NaCl은 강염기 (IA 계열이기 때문에)에서 나오고 Cl은 강산 (HCl)에서 나오기 때문에 중성 염입니다.
d) 거짓. 에서2뿐4 Na는 강염기 (IA 계열이기 때문에)에서 나오기 때문에 중성 염입니다.4 강산 (H2뿐4).
가짜입니다. HCl은 산이며 염기가 필요합니다.
2.2- (Enem- 2014) 환경에 미치는 영향을 최소화하기 위해 브라질 법률은 수용 기관으로 직접 방출되는 화학 잔류 물이 5.0에서 9.0 사이의 pH를 갖는 것으로 결정합니다. 산업 공정에서 생성되는 수성 액체 폐기물은 1.0.10과 동일한 수산기 이온 농도를 갖습니다.-10 정부. 법규를 준수하기 위해 화학자는 회사 창고에서 구할 수있는 다음 물질을 분리했습니다. CH3COOH, Na2SO4, CH3오, 케이2CO3 및 NH4Cl.
지금 멈추지 마세요... 광고 후 더 있습니다;)
잔류 물이 수용체로 직접 방출되기 위해 pH를 조정하는 데 사용할 수있는 물질은 무엇입니까?
a) CH3COOH
b) 안으로2뿐4
c) CH3오
d) K2CO3
e) NH4Cl
정답: 문자 D
해결
1 단계: 잔류 물의 pH를 결정합니다.
운동은 잔류 물에 10과 같은 수산화물 농도가 있음을 나타냅니다-10.
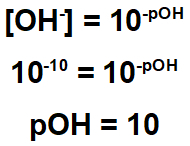
따라서이 잔류 물의 pH를 계산할 수 있습니다.

위로부터 pH가 7 미만이므로 잔류 물이 산성 특성을 가지고 있음을 알 수 있습니다. 따라서이를 중화시키기 위해서는 기본적인 성격의 물질을 사용하는 것이 필수적이다.
2 단계: 각 소금의 특성을 결정하여 CH와 같이 기본 소금을 나타냅니다.3COOH (대안 a)는 산이고 CH3OH (대안 c)는 산성 특성을 가진 알코올, 유기 등급입니다.
b) 중성 염, Na는 강한 염기 (IA 계열이기 때문에)에서 나오고 SO4 강산 (H2뿐4).
d) 염기성 염, K는 강한 염기 (IA 계열이기 때문에) 및 CO3 약산 (H2CO3).
e) NH로서 산성 염4 약염기 (NH4OH), Cl은 강산 (HCl)에서 나온다.
2.3- (Enem- 2014) 한 연구원은 그가 농축 된 소화 효소를 보관하고있는 항아리 중 하나의 라벨을 읽을 수 없음을 발견했습니다. 그는 유리에 어떤 효소가 포함되어 있는지는 모르지만 단백질을 소화하여 위장에서 작용하는 위 프로테아제라고 의심합니다. 위장의 소화가 산성이고 장이 염기성이라는 것을 알고 음식과 함께 5 개의 시험관을 조립합니다. 다르게, 결정된 pH를 가진 용액에 효소 농축액을 첨가하고 효소가 어떤 작용을하는지 기다리십시오 그들의. 연구자의 가설이 옳다는 것을 나타 내기 위해 효소가 작용해야하는 시험관은 다음을 포함하는 시험관입니다.
a) pH = 9 인 용액의 감자 큐브
b) pH = 5 인 용액의 고기 조각.
c) pH = 9의 용액에 삶은 달걀 흰자.
d) pH = 5 인 용액의 국수 부분.
e) pH = 9 인 용액의 버터 볼.
정답: 문자 B
이 운동은 학생에게 음식에 대한 생화학 적 지식과 좋은 해석과 상관 관계를 요구합니다. 그는 연구원이 효소가 소화라고 생각하고 산성 pH에서 작용하며 단백질에 작용한다고 말합니다 (단백 분해 효소이기 때문에).
이 효소가 산성 환경에서 작용하는 경우 pH는 7 미만이어야합니다. 고기는 단백질로 구성되고 파스타는 탄수화물로 구성됩니다. 그래서 정답은 대안 b입니다.
2.4- (Enem- 2012) 한 주부가 실수로 냉장고에 생선을 해동하면서 물을 떨어 뜨려 기기 내부에 강하고 불쾌한 냄새가 남았습니다. 생선의 특유한 냄새는 아민 때문이며 이러한 화합물은 염기로 작용하는 것으로 알려져 있습니다. 표에는 주방에서 발견되는 일부 재료의 수소 농도가 나열되어 있으며, 주부가 냉장고를 청소할 때 사용할 것을 고려하고 있습니다.

나열된 재료 중이 냄새를 완화하는 데 적합한 재료는 무엇입니까?
a) 알코올 또는 비누
b) 레몬 주스 또는 알코올
c) 레몬 주스 또는 식초
d) 레몬 주스, 우유 또는 비누
e) 비누 또는 소다 / 소다회
정답: 문자 C
해결
이 연습은 주부의 냉장고가 기본적인 성질의 물질로 인해 강한 냄새가 나는 문제 상황을 제안한다. 따라서이 문제를 해결하는 데 어떤 재료가 흥미로운 지 의문을 제기합니다.
염기를 중화하려면 산성 또는 pH가 7 미만인 물질을 사용해야합니다. 운동이 H 농도의 값을 제공 한 방법+ 자료 중, 아래 식에서 각각을 사용하는 것으로 충분했습니다.

그러므로:
주스: pH = 2
우유: pH = 6
식초: pH = 3
알코올: pH = 8
비누: pH = 12
배럴: pH = 12
산성 물질은 주스, 식초 및 우유입니다. 따라서 대안 c만이 산성 물질을 가져옵니다.
3. Enem의 평형 상수
3.1- (Enem-2016) 완전히 마모 된 후에는 발전을 위해 타이어를 태울 수 있습니다. 가황 고무의 완전 연소에서 발생하는 가스 중 일부는 오염 물질로 산성비를 유발합니다. 이러한 가스가 대기 중으로 빠져 나가는 것을 방지하기 위해 이러한 가스를 적절한 물질이 포함 된 수용액으로 버블 링 할 수 있습니다. 아래 표에 나열된 물질 정보를 고려하십시오.

표에 나열된 물질 중 오염 가스를 가장 효율적으로 제거 할 수있는 물질은 다음과 같습니다.
a) 페놀.
b) 피리딘.
c) 메틸 아민.
d) 인산 수소 칼륨.
e) 황산 수소 칼륨.
정답: 문자 D
해결
이 운동은 오염 가스가 산성비를 촉진하는 문제 상황을 제기합니다. 그런 다음 그는 언급 된 물질 중 어떤 물질이 이러한 가스를 중화하고 결과적으로 산성비를 피하는 데 흥미로울 지 묻습니다.
산성비를 피하기 위해 산성 가스는 염기성 용액을 사용하여 중화되어야합니다. 이 특성을 가진 물질은 OH기를 우선적으로 방출하는 물질입니다.- 중간에. 표에서 피리딘, 메틸 아민 및 인산 수소 칼륨은 염기성 물질입니다.
따라서보다 효율적으로 오염 가스를 제거 할 수있는 물질을 결정하기 위해서는 이온화 상수 값을 분석해야합니다. 상수가 클수록 OH를 방출하는 능력이 커집니다.-. 그래서 인산 수소 칼륨 이 경우 가장 적합한 물질입니다.
3.2- (Enem-2015) 여러 산은 환경 균형에 영향을 미칠 수있는 강과 호수와 같은 수역에서 폐수를 처리하는 산업에서 사용됩니다. 산도를 중화시키기 위해 탄산 칼슘 염은 물을 중화시키는 중탄산염을 생성하므로 폐수에 적절한 양으로 첨가 할 수 있습니다. 프로세스와 관련된 방정식이 표시됩니다.

반응 II, III 및 IV의 평형 상수 값을 기준으로 25에서영형 C, 반응 I의 평형 상수의 수치는 얼마입니까?
a) 4.5x10-26
b) 5x10-5
c) 0.8x10-9
d) 0.2x105
e) 2.2x1026
정답: 문자 B
해결
이 운동에는 지속적인 이온화가 포함됩니다. 처음에는 방정식 I이 실제로 방정식 II, III 및 IV의 결과 (합계)임을 이해하는 것이 중요합니다. 따라서 해결을 시작하려면 다음 원칙을 사용해야합니다. 헤스의 법칙.
1 단계: 헤스의 법칙 사용.
방정식 II를 반전하고 방정식 III 및 IV를 유지하면 다음과 같은 결과를 얻을 수 있습니다.
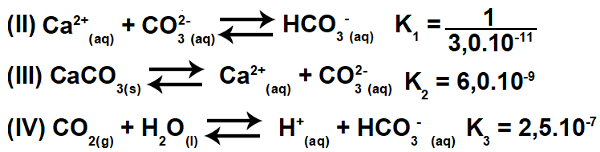
따라서 우리는 음이온 CO가3-2 및 양이온+ 제거되고 방정식의 합이 방정식 I가됩니다.
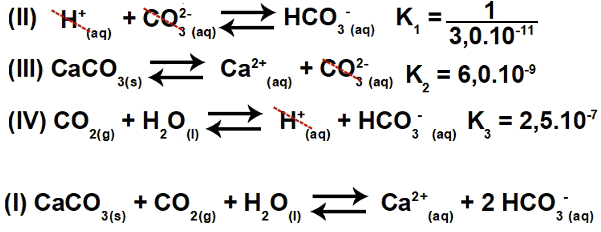
2 단계: 상수 계산
이온화 방정식의 평형 상수는 항상 다른 방정식의 상수를 곱하여 제공됩니다.

나. Diogo Dias

