기하학적 이성질체 또는 cis-trans 입체 이성체라고도하는 공간 이성체의 한 유형이므로 이러한 유형의 이성체를 나타내는 화합물을 입체 이성체라고합니다. 이중 결합을 가진 지방족 (개방 사슬) 분자 또는 고리 형 화합물에서만 발생합니다.
불포화 개방 사슬 화합물에서 이중 탄소에 결합하는 원자가 다른 경우 서로간에 그리고 다른 탄소 원자의 리간드와 동일하게, 우리는 그들 사이에 두 개의 이성질체 화합물이 형성 될 것입니다. ㅏ cis 그리고 또 다른 트랜스.
입체 이성질체가 있는지 확인하려면 cis 또는 트랜스 분자를 구성하는 원자의 공간적 배열을 아는 것이 필요합니다.
1,2- 디클로로-에틸렌의 예를 살펴 보겠습니다.
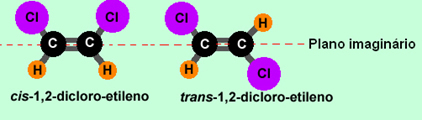
첫 번째 경우 동일한 리간드가 평면의 같은면에있는 이성질체 cis. 두 번째 분자에서 동일한 리간드는 평면의 반대편에 있으므로 이성질체입니다. 트랜스.
원자의 공간적 위치의 차이로 인해 화합물이 cis 이성체와는 다른 특성을 가짐 트랜스.
따라서 지방족 (개방 사슬) 화합물에서 기하학적 인 시스-트랜스 이성질체가 발생하기 위해서는 화합물은 탄소 사이에 적어도 하나의 이중 결합을 가져야하며 이중의 각 탄소는 서로 다른 결합기를 가져야합니다.
지금 멈추지 마세요... 광고 후 더 있습니다;)
그러나 모든 리간드가 다르면 어떤 리간드가 될지 어떻게 알 수 있습니까? cis 그리고 어느 것이 될 것입니다 트랜스?
이 경우 리간드의 원자 번호가 고려됩니다.. 원자 번호가 가장 높은 두 리간드가 평면의 같은면에 있으면 이성질체는 cis. 그러나 반대편에 있으면 이성질체라고합니다. 트랜스.
예를 들어, 2- 클로로 -2- 부텐 분자의 경우 첫 번째 탄소에서 가장 높은 원자 번호를 가진 리간드는 Cl이고 두 번째 탄소에서 가장 높은 원자 번호를 가진 리간드는 CH입니다.3. 그래서 우리는 :
ClCH3Cl H
│ │ │ │
C C C
│ │ │ │
H3CH H3씨 CH3
Cis-2-chloro-2-butene Trans-2-chloro-2-butene
이러한 유형의 입체 이성질체가 고리 형 화합물에서 어떻게 발생하는지 알아 보려면 텍스트를 읽으십시오.“기하 이성질체 cis-trans 사이 클릭 화합물에서”
작성자: Jennifer Fogaça
화학 전공
이 텍스트를 학교 또는 학업에서 참조 하시겠습니까? 보기:
FOGAÇA, Jennifer Rocha Vargas. "기하학적 또는 시스-트랜스 이성질체"; 브라질 학교. 가능: https://brasilescola.uol.com.br/quimica/isomeria-geometrica-ou-cis-trans.htm. 2021 년 6 월 27 일 액세스.
b) 기하학적 이성질체를 나타내는 각 화합물의 공간 공식을 만드십시오.