エネルギー内部 の合計です 運動エネルギー 体の構成原子や分子の動きに関連するポテンシャル。 内部エネルギーも正比例します 温度 体の。 これは、ジュール(SI)で測定され、次のような変数の関数として決定されるスカラー量です。 圧力 (P)、 ボリューム (V)と 温度 システムの熱力学(T)、ケルビン(K)。
体の温度が高いほど、その内部エネルギーが大きくなるため、何らかの仕事をする能力が高くなります。 さらに、例えば、単原子ガスの内部エネルギーは、 運動エネルギー ガスのすべての原子の。 二原子ガスなどの分子ガスを扱う場合、分子相互作用を考慮に入れる必要があります。 これにより、内部エネルギーは、分子の運動エネルギーとその間に存在する位置エネルギーの合計によって決定されます。 彼ら。
今やめないで... 広告の後にもっとあります;)
理想的な単原子ガスの内部エネルギー
理想的な単原子ガスの原子間には相互作用がないため、その内部エネルギーは、モル数(n)とガス温度(T)の2つの変数にのみ依存します。 見る:

U - 内部エネルギー
番号 –モル数
R –完全ガスの普遍定数
T –温度
上記の式では、 R それは0.082気圧の弾性率を持っています。 L / mol。 Kまたは8.31J / mol。 K(SI)。 また、圧力や体積などの他の量に関して上記の方程式を書くことができます。 そのためには、覚えておく必要があります クラペイロンの方程式、理想気体に使用されます。

上記の式を前の式に代入すると、内部エネルギーの計算には次の式が得られます。

見てまた:完全気体とは何ですか?
上記の方程式を考慮に入れると、理想的な単原子ガスの原子の運動エネルギーとその温度との関係を決定することができます。 このために、このタイプのガスの運動エネルギーは次のようになります。 純粋に動力学。 見る:

m - パスタ
番号 –モル数
M - モル質量
多くの場合、ガスの内部エネルギー(ΔU)の変動を計算する方法を知ることは興味深いことです。この量は、ガスが 受け取った または 与えた エネルギー。 ガスの内部エネルギーの変動が正の場合(ΔU> 0)、ガスはエネルギーを受け取ります。 そうでなければ(ΔU<0)、ガスはそのエネルギーの一部を放棄するでしょう。

ガス量の変動による内部エネルギーの変動。
二原子ガスの内部エネルギー
理想的な二原子ガスの場合、内部エネルギーはわずかに異なる方程式で与えられます。

熱力学的変換とサイクルにおける内部エネルギー
による 熱力学の第1法則、理想気体の内部エネルギーは特定の場合に変化する可能性があります 熱力学的変換、周囲とシステムの間で交換される熱の量、およびシステムによって、またはシステム上で実行される作業によって異なります。

Q - 熱
τ -仕事
次に、この法則が特定の熱力学的変換に対して取る形式を見てみましょう。
見てまた:熱機械の歴史
→内部エネルギー:等温変換
で 等温変換、温度変化がないため、内部エネルギーは一定に保たれます。

この場合、システムと交換される熱の全量が仕事に変わり、逆もまた同様です。
→内部エネルギー:等容性変換
で 等容性変換、システムは剛性があり膨張しない容器に閉じ込められているため、作業を行うことはできません。 この場合、システムと交換される熱の全量が、システムの内部エネルギーを直接変化させます。

→内部エネルギー:等圧変換
このタイプの変換では、システムは 定圧したがって、彼または彼に対して行われた作業は分析的に計算できます。

→内部エネルギー:断熱変換
の中に 断熱変換、システムとその周囲との間に熱交換がないため、内部エネルギーの変動は、システムによって実行される作業またはシステム上で実行される作業にのみ依存します。

循環プロセスにおける内部エネルギー
すべての循環プロセスにおいて、システムの熱力学的状態は、その圧力、体積、および温度変数(P、V、T)で表されます。 変換されますが、最終的に元の状態(P、V、T)に戻るため、このタイプのプロセスの内部エネルギーの変動は常にヌルになります(ΔU = 0).
見てまた:循環変換
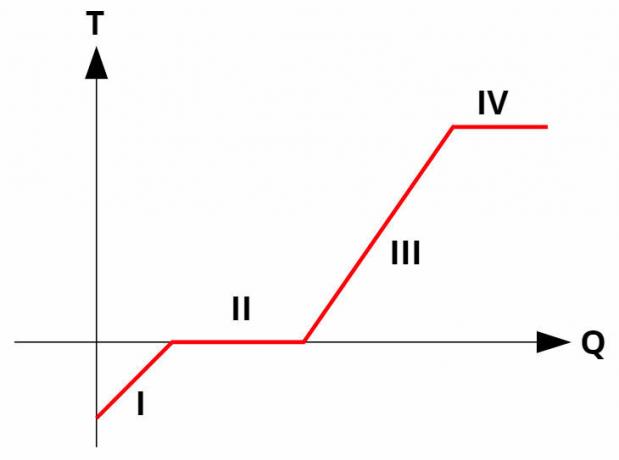
下のグラフを見てください。これは、状態AとBの間の3つの異なる熱力学的変換を示しています。

3つの変換(I、II、III)が状態Aを離れ、状態Bに進むとき、内部エネルギーの変動はすべての変換で等しくなければなりません。したがって、次のようになります。

内部エネルギー演習
1) モル質量が24g / molの理想的な二原子ガス2モルが、温度500 Kで、体積が10に等しい密閉された剛性のある容器内にあります。-3 m³。 決定:
a)このガスの内部エネルギーのジュール単位の係数。
b)ガスが容器の壁に及ぼす圧力。
解決:
) これは理想的な二原子ガスであるため、次の式を使用して内部エネルギーを計算します。

演習ステートメントで通知されたデータを使用すると、次の計算を解決する必要があります。

B) 容器の容積がわかれば、ガスが及ぼす圧力を決定できます。10-3 m³。 これを行うには、次の式を使用します。

私によって。ラファエル・ヘラーブロック