緩衝液は通常、弱酸とその酸の塩、または弱塩基とその塩基の塩の混合物です。 この溶液は、溶液のpHまたはpOHの非常に大きな変動が発生するのを防ぐことを目的としています。
以下は、緩衝液のいくつかの例です。
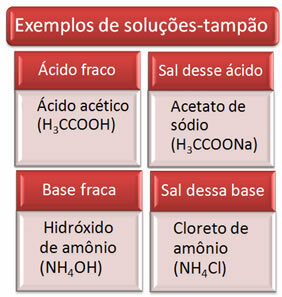
緩衝液の有効性は私たちの血液に見られます。血漿に少量の酸または塩基を加えても、そのpHはほとんど変化しません。
水に酸や塩基を加えると、そのpHが急速に変化することを考えると、これはどのように起こりますか?
人間の血液はわずかに基本的な緩衝システムです。つまり、緩衝液です。pHは7.35から7.45の間で一定に保たれます。 血液中の最も興味深く重要な緩衝液の1つは、炭酸(H2CO3)そしてこの酸の塩によって、重炭酸ナトリウム(NaHCO3).
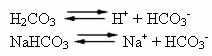
したがって、この緩衝液には次の種が含まれます。
H2CO3:弱酸であるため、イオン化が少ないため、大量に存在します。
H+:Hのイオン化から2CO3;
HCO3-:Hのイオン化からも大量に存在2CO3 および塩の解離(NaHCO3);
で+:NaHCOのイオン化から3;
今やめないで... 広告の後にもっとあります;)
この溶液に低濃度の酸を加えると、そのイオン化が起こり、Hカチオンが生成されます。+、HCOアニオンと反応します3- 培地中に存在し、非イオン化炭酸を生成します。 pHに変化はありません。
塩基を加えると、OHアニオンが生成されます-. これらのイオンはHカチオンと結合します+、Hのイオン化から2CO3. したがって、OHアニオン- 中和され、培地のpHを維持します。
言及されたこの緩衝液に加えて、血液中に存在する他の2つの緩衝液もあります:H2ほこり4/HPO42- といくつかのタンパク質。 血液中にそのような緩衝液がない場合、pH範囲が大幅に歪む可能性があります。 血中pHが7.8を超えると、アルカローシスと呼ばれます。 pHが6.8未満に下がりすぎると、アシドーシスの状態になります。 どちらも死に至る危険な状態です。

ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "人間の血液中の緩衝液"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm. 2021年6月28日にアクセス。



