THE クラペイロン方程式 次のような量を関連付ける数式です。 圧力 (P)、体積(V)、温度(T)、およびを構成する粒子の数(n) 完璧または理想気体. この方程式は、フランスの物理学者にちなんで名付けられました ポールエミールクラペイロン そして、の経験則の一般化として理解することができます ガス完璧にゲイ・ルサック、シャルル、ボイル。 それは理想気体の研究の基礎であり、 サーマルマシン、過去数十年にわたってそれらをますます効率的にしています。
も参照してください: 事故によって起こった物理学の発見
クラペイロンの方程式:理想気体の法則
クラペイロンの方程式は 3つの経験則から導き出されたつまり、実験から決定された法則. そのような法則は、ガスの振る舞いを説明しています ガス変換等容性 (ゲイ・リュサックの法則)、 等圧 (シャルルの法則)と 等温線 (ボイルの法則)。 これらの法律によると:
変換で 等容性、理想気体の圧力と熱力学的温度の比率は一定のままです。
変換で 等圧、 理想気体の体積と熱力学的温度の比率は一定です。
- 変換で 等温線、理想気体の圧力と体積の積は一定のままです。
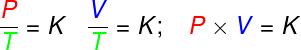
P –圧力(Pa –パスカル)
V –ガス量(m³)
T –熱力学的ガス温度(K –ケルビン)
上記の3つの法則から、クラペイロン方程式はこの値が何であるかを決定します 絶え間ない (K) 前述の各変換で得られます。 クラペイロンの方程式によれば、この定数はモル数にaを掛けたものに等しくなります。 定数R、理想気体の普遍定数として知られ、に等しい ボルツマン定数 を掛ける アボガドロの数.
式
として知られている式をチェックしてください 方程式にクラペイロン:
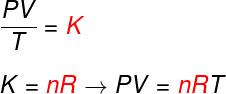
番号 –モル数(mol)
R –理想気体の普遍定数(R = 0.082 atm.l / mol。 Kまたは8.314J.mol / K)
クラペイロン方程式を分析すると、 圧力 理想気体によって発揮されるのは 温度に正比例 そしてまたに モル数. さらに、 圧力は体積に反比例します ガスで占められています。
O 理想気体モデル クラペイロン方程式によって可能になったものは、 によって動力を与えられる機械の開発 流体、蒸気動力機械や内燃機関など。
クラペイロン方程式からいくつかの重要な結果を得ることができます。 たとえば、そのうちの1つは、1モルの理想気体が次の体積を占めると予測しています。 22.4リットル の圧力を受けたとき 1気圧 (1,01.105 Pa)そしての温度で 273K (0°C)。
も参照してください: サーモロジーの最も重要な概念
クラペイロン方程式の解いた演習
質問1-(UECE) PV = nRTによって関連付けられた温度、体積、および圧力を持つことができるガスには、次の特性があります。
a)衝突する場合を除いて、分子間相互作用を無視するための分子間の非常に大きな平均距離。 分子は弾性衝突を起こします。
b)分子間の平均距離が非常に小さい。 分子は非弾性衝突を起こします。
c)衝突する場合を除いて、分子間相互作用を無視するための分子間の非常に大きな平均距離。 分子は非弾性衝突を起こします。
d)分子間の平均距離が非常に大きく、分子間相互作用が強い。 分子は弾性衝突を起こします。
解決:
理想気体モデルでは、多数の無次元粒子がランダムな方向に高速で移動します。 これらの粒子が被る唯一の相互作用は完全に弾性衝突であるため、正しい代替手段は次のとおりです。 文字a.
質問2—(UFRGS) 理想気体に関する次の記述を考慮してください。
私。 気体の状態方程式pV = nRTに存在する定数Rは、すべての理想気体で同じ値になります。
II。 同じ温度と圧力で、等量の異なる理想気体には、同じ数の分子が含まれています。
III。 理想気体の分子の平均運動エネルギーは、気体の絶対温度に正比例します。
どれが正しいですか?
a)私だけ
b)IIのみ
c)IIIのみ
d)IとIIのみ
e)I、IIおよびIII
テンプレート:
代替案を見てみましょう:
私。 正しい、 したがって、それは理想気体の普遍定数と呼ばれます。
II。 正しい. クラペイロンの方程式によれば、2つの理想気体の圧力、温度、体積が同じである場合、それらの気体の粒子数は等しくなります。
III。 正しい. エネルギー等分配の法則によれば、理想気体中の粒子の運動エネルギーはその温度に比例します。
したがって、正しい代替手段は 文字e.
質問3— (UFJF)Clapeyron、Boyle、Mariotte、Gay-Lussac、van der Wallsなどの男性は、ガスの特性に関する重要な研究を開発しました。 実在気体の挙動は、低圧条件での理想気体、および大量に含まれる気体と高温で保持される気体に近似します。 実験室での実験では、体積Vの容器は完全に閉じており、4.0の圧力で1molの理想気体が含まれていると考えてください。 atmは、127ºCに等しい一定温度で膨張し、このガスの挙動は、に示すように理想気体の挙動です。 グラフィック。
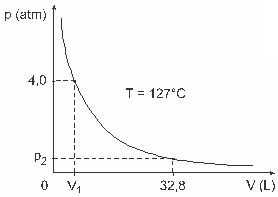
この場合、ガスが32.8 Lに等しい体積を占めるとき、ガスによって加えられる圧力は次のようになります。
(与えられた:完全ガスの普遍定数はR = 0.082atmです。 L / mol。 K.)
a)0.32 atm
b)0.40気圧
c)1.0気圧
d)2.0気圧
e)2.6気圧
解決:
文字C。
演習を解決するには、データをクラペイロン方程式に適用する必要がありますが、その前に、摂氏で表される温度をケルビンに変換する必要があります。 チェックアウト:

ラファエル・ヘラーボック
物理の先生
ソース: ブラジルの学校- https://brasilescola.uol.com.br/fisica/a-equacao-clapeyron.htm
