で 普通電池 と呼ばれる ルクランシェ電池 その発明者であるフランスの化学者GeorgeLeclanché(1839-1882)にちなんで名付けられました。

ジョルジュ・ルクランシェ(1839-1882)
ルクランシェは1866年にこのタイプのバッテリーを作成しました。 彼女はまた呼ばれます 乾電池 それまでは、水溶液を使った電池しかなかったからです。 ダニエルの山.
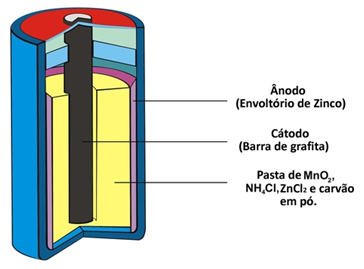
このタイプの杭がその構成のために受け取る他の2つの名前は次のとおりです。 アシッドパイル または マンガン乾電池. それは基本的に、多孔質紙によってパイルを構成する他の化学種から分離された亜鉛エンベロープによって形成されます。
この亜鉛は、以下の半反応に従って、酸化して2つの電子を失うため、セルまたはアノードの負極に対応します。
マイナス極-アノード:Zn (s) →Zn2+(ここに) +2および-
この杭には、二酸化マンガン(MnO)に囲まれた杭の中央に設置されたグラファイトバーである正極である陰極もあります。2)、粉末炭(C)および塩化アンモニウム(NH)を含むウェットペースト4Cl)、塩化亜鉛(ZnCl2)と水(H2O)。
塩化アンモニウムと塩化亜鉛は酸性の塩であるため、「酸電池」と呼ばれています。
グラファイトバーは、亜鉛によって失われた電子をマンガンに伝導し、二酸化マンガン(MnO)を還元します。2)三酸化マンガン(Mn2O3)、次の半反応によると:
正極-カソード:2 MnO2(aq) + 2 NH41+(ここに) + 2e- →1Mn2O3(s) + 2NH3(g) +1時間2O(1)
今やめないで... 広告の後にもっとあります;)
ウェットペーストは塩のポイントとして機能し、ヒドロキシルアニオン(OH)の移動を可能にします-)グラファイトから亜鉛へ。
全体的な反応は次のようになります。
亜鉛 (s) + 2 MnO2(aq) + 2 NH41+(ここに) →Zn2+(ここに) + 1 Mn2O3(s) + 2NH3(g)
そのため、これらのバッテリーは、二酸化マンガンがすべて三酸化マンガンに変換されるため、充電できません。 バッテリーが機能しなくなったら、廃棄する必要があります。
これらのバッテリーのddpは1.5Vです。 ただし、アンモニア(NH3(g))カソードで形成されたものは、グラファイトバーに堆積する可能性があり、電子の通過を妨げ、バッテリーの電圧を低下させます。 通常の動作に戻すには、亜鉛カチオン(Zn)として、バッテリーをデバイスの外に置いたままにします。
2+(ここに))アノードで形成されたものはアンモニアと反応し、グラファイトバーを解放します。さらに、温度を下げるとパイル内の湿ったペーストへのアンモニアの溶解度が高くなるため、パイルを冷蔵庫に置くことも役立ちます。
私たちが考慮しなければならないルクランシェ乾電池に関するもう1つの重要な要素は 亜鉛ケーシングは腐食し、腐食性物質を漏らしてデバイスを損傷する可能性があります。. したがって、最善の方法は、継続的に使用されないデバイス内にバッテリーを残さないことです。
乾電池は、リモコン、掛け時計、携帯ラジオ、おもちゃなど、軽くて連続的な放電が必要な機器に適しています。
ジェニファー・フォガサ
化学を卒業
学校や学業でこのテキストを参照しますか? 見てください:
FOGAÇA、ジェニファー・ロシャ・バルガス。 "ルクランシェのドライスタック"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/pilha-seca-leclanche.htm. 2021年6月28日にアクセス。