O pH 溶液の量は、ヒドロニウムイオン(H3O+)真ん中に存在します。 この内容は、分析された溶液が酸性、塩基性、または中性の特性を持っているかどうかを決定します。
観察: ヒドロニウム含有量(H3O+ またはH+)は、pH指示薬テープを使用して実験室で簡単に取得できますが、精度は高くありません。 測定で-または逆に、のpHを測定する際に非常に正確なpeagometerと呼ばれる機器を使用して 解決。
溶液のpHを測定するための歩数計またはポテンショメータ
実行するには pHを含む計算 解の場合、次の対数方程式を使用できます。
pH = --log [H3O+]
または
pH = --log [H+]
重要: 溶液のpHを含む計算では、常に常用対数を使用します。
マインドマップ:ソリューションのPHの計算

*マインドマップをPDFでダウンロードするには、 ここをクリック!
上記の対数方程式から、この方程式の次の簡略化(対数関数を適用することによって得られる)を引き続き使用できます。
[H3O+] = 10-pH
観察:上記の簡略化された式は、pH値が整数の場合にのみ使用できます。 それ以外の場合は、対数関数を使用する必要があります。
溶液のpHを含む計算は、常にpOH(ヒドロキシルイオンポテンシャル/ OH)に関連していることを強調することが重要です。-)、両方の効力は水の自己イオン化に基づいているため(Kw = 10-14、水が大量のHを生成する現象+ いくらああ-)およびオストヴァルトの希釈法則(溶液を希釈すればするほど、Hカチオンの量が多くなります)+ ). したがって:
約 水の自動イオン化:
Kw = [H+]. [ああ-]、したがってpH + pOH = 14
の法則 オストヴァルト希釈(それを通して、特定の物質が水中でどれだけイオン化または解離するかを知ることができます):
K私 =M.α2
Ki =水性媒体中の物質のイオン化定数。
M =水性媒体中の物質のモル濃度またはモル濃度。
α2 =媒体中の材料のイオン化または解離の程度。
溶液を酸性、塩基性、または中性に分類するには、次の基準があります(25 OÇ):
-
1 溶液は中性になります Hの濃度が+ OHの濃度に等しい- またはpHが7に等しい。
今やめないで... 広告の後にもっとあります;)
[H+] = [OH-]
1 溶液は酸性になります Hの濃度が+ OH濃度よりも大きい- または、pHが0から7の間です。
[H+]> [OH-]
1 ソリューションは基本になります Hの濃度が+ OH濃度未満です- またはpHは7から14の間です。
[H+] -]
溶液のpHを含む計算のいくつかの例を参照してください。
1º)コーヒー中のヒドロニウムの濃度が1.10に等しいことを知っている-5、この溶液に存在するpHは何ですか?
運動する方法 ヒドロニウム濃度を提供 コーヒーの場合、 簡略化されたpH式を使用する:
[H3O+] = 10-pH
1.10-5 = 10-pH
10-5 = 10-pH
-5 = -pH
pH = 5
pHが7未満であるため、溶液は酸性です。
2º) (UFU) Kを仮定すると、0.045 mol / L酢酸溶液のpHはいくつですか。私 = 1,.10-5? データ:log 2 = 0.3; log 3 = 0.48。
運動データ:
M = 0.045 mol / L
K私 = 1,8.10-5
log 2 = 0.3
log 3 = 0.48
演習がどのように提供したか モル濃度(M)とイオン化定数(K私),最初に、言及された酸のイオン化の程度を決定しましょう、 ヒドロニウムの濃度(H3O+ またはH+)は常にモル濃度とイオン化の程度の間の乗算の結果です。 すぐに:
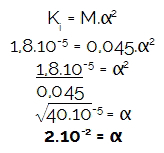
次に、計算してみましょう モル濃度を掛けるヒドロニウムの量 見つかったイオン化の程度による酸の分析:
[H3O+] =M.α
[H3O+] = 0,045.2.10-2
[H3O+] = 0,09.10-4
[H3O+] = 9.10-4 mol / L
最後に、 対数pH式のヒドロニウム濃度値:
pH = --log [H3O+]
pH = --log 9.10-4
pH = 4-log 9
pH = 4-log 32
pH = 4-2。 (ログ3)
pH = 4-(2.0.48)
pH = 4-0.96
pH = 3.04
pHが7未満であるため、溶液は酸性です。
3º)(Cefet-PR)A 45 OC、中性溶液のKwは4.10に等しい-4. では、この温度でのこの溶液のpH値は何ですか? ログ2データ= 0.3。
演習で解決策がどのようにわかるか 中性、すぐに [H3O+]は[OHに等しい-]:

最後に、 対数pH式のヒドロニウム濃度値:
pH = --log [H+]
pH = --log 2.10-7
pH = 7-log 2
pH = 7-0.3
pH = 6.7
pHがほぼ7であるため、温度が45であるため、溶液は中性です(演習の説明に示されています)。 OÇ。
私によって。DiogoLopesDias
学校や学業でこのテキストを参照しますか? 見てください:
DAYS、ディオゴロペス。 "溶液のpHを含む計算"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/calculos-envolvendo-ph-solucoes.htm. 2021年6月28日にアクセス。
オストワルドの法則、イオン化定数、モル濃度、イオン化の程度、強電解質、イオン化されたモル数、フリードリッヒヴィルヘルムオストワルド、一酸、一塩基。