構造式は、元素間の結合を表す方法であり、2つの原子間で共有される電子の各ペアはダッシュで表されます。
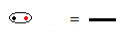
ダッシュで表される共有電子対
これは、単一、二重、三重を問わず、すべてのタイプの共有結合が構造式に現れることを意味します。
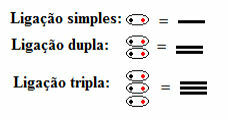
構造式のダッシュで表される単一、二重、三重結合
結合がほとんどない小分子構造式の例をいくつか見て、共有電子対がどのように表されているかに注目してください。
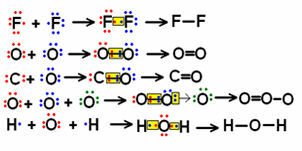
いくつかの分子の構造式の例
電子ペアが「ドット」で表されている左上の式は、次のように呼ばれます。 電子式 または ルイスの公式. これらの分子はすべて無機物質ですが、有機化合物の場合は一般に構造式がより多く使用されます。 元素炭素によって形成されたものであり、鉱物起源ではありません(一酸化炭素(CO)の場合のように、 無機)。
炭素は4価(4つの共有結合を作る)なので、 さまざまな原子や他の炭素に結合して、無限の鎖を形成する能力 炭酸。 だから構造式が重要なのは鎖内の原子の配置を示します。
理解するには、次のことを考慮してください。 分子式 物質の分子内の各元素の数のみを示します。 たとえば、分子式Cがあるとします。3H6、3つの炭素原子と6つの水素原子があることがわかりますが、それらはどのように結合していますか? 構造式はこれを教えてくれ、実際にそれがどの化合物であるかを知ることができます。 この分子式は、2つの異なる構造式を生成し、その結果、2つの異なる物質を生成する可能性があることに注意してください。

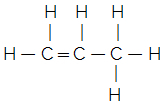
シクロプロパンプロペン
これらは呼び出すことができます平らな構造式、すべての接続とすべての要素が紙、黒板、コンピューター画面などの平面に描かれています。
今やめないで... 広告の後にもっとあります;)
ただし、多くの炭素鎖は非常に大きく、非常に複雑であるため、構造式を毎回フラットに記述する必要はありません。
したがって、分子の構造をより単純化した他の形式の表現が作成されました。 最初は 簡略化または凝縮された構造式、各炭素に結合している水素原子の量は、その記号(H)を付けることによって省略されます。 一度だけ、右下隅にインデックスを追加します。これは、水素の数を示す数値です。 有る。
たとえば、一般的なエーテルのフラットな構造式を考えてみましょう。
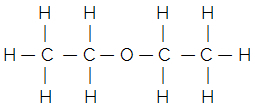
その簡略化または要約された構造式は、次の式で与えられます。
H3C — CH2 — o — CH2 — CH3
ずっと簡単ですね!
しかし、炭素は常に4つの結合を作り、水素は1つの結合しか作らないことを知っていると、ダッシュの式である別のさらに単純な式が出現しました。 あなたが望むなら、あなたはそれをテキストでより詳細に書く方法を見ることができます 有機化合物の分子式. しかし、基本的に、この式では、グループC、CH、CHは省略されています2 およびCH3、ジグザグに接続されたダッシュで表されます。 以下に、前述のエーテルの構造式を示します。
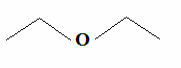
一般的なエーテルトレース式
しかし、物質の公式が空間的に正確に平坦ではないことは非常に真実です。 したがって、場合によっては、より空間的なアイデアを与えるために、彼らは次のように書いています 遠近法の式、リンクが示すことができる場所 原子が平面内(法線ストローク)、平面の後ろ(点線のくさび)、または平面の前(完全なくさび)のいずれにあるか:

パースペクティブでの数式での表現
たとえば、以下のコルチゾール式を見てください。 1つの水素、1つのヒドロキシル基(OH)、および2つのメチル基(CH3 –省略されている)は平面の前にあり、2つの水素とヒドロキシル基は平面の後ろにあり、残りは平面内にあります。

コルチゾールの観点から見た構造式
ジェニファー・フォガサ
化学を卒業
化学式、フラット構造式、クーパー構造式、三重結合、ガス 窒素、電子式、ルイス式、分子式、単結合、二重結合、ガス 炭酸。
