化学元素 リン(P) 周期表の第3周期と窒素(VA)ファミリーに属しています。 このため、その原子は通常3つになります 化学結合 に到達する オクテット理論 (安定)。 ただし、リン原子が3つ以上の結合を形成する状況がいくつかあります。これは、 ハイブリダイゼーション現象.
を理解するには リン混成、 最初に、この元素の原子が3つの結合を作る理由を理解する必要があります。 これを行うには、電子配信を監視する必要があります。

電子リンの分布
原子価層では、リン原子が完全な3sサブレベルを持っていることがわかります( 2つの電子)と不完全な3pサブレベル(3つのpサブレベル軌道のそれぞれに 電子)。 以下に、のサブレベルの軌道における電子の分布を示します。 リンの原子価層:
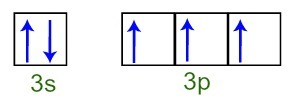
リン原子の価電子の表現
3pサブレベル軌道のそれぞれが不完全であるため、リン原子は3つの化学結合を形成することができ、安定性を実現します。
さて、物質PClを見ると5たとえば、この分子では、リンが5つの接続を行ったため、混成軌道に乗ったと確信しています。 VIIAファミリーに属する塩素は、安定するために結合が必要であり、分子にはこの5つの原子があります。 元素、それらのそれぞれは結合を作らなければなりません、そしてそれはリン原子を作ります、そしてまた5つを作らなければなりません 接続。 この発生は、 リンの混成(不完全な原子軌道の結合).
今やめないで... 広告の後にもっとあります;)
外部環境からエネルギーを受け取ると、リン原子の電子が励起されます。 その後すぐに、3sサブレベルに属する2つの電子の1つが、dサブレベルに存在する空の軌道に移動します。この軌道にはそれまで電子がありません。 次の図を参照してください。
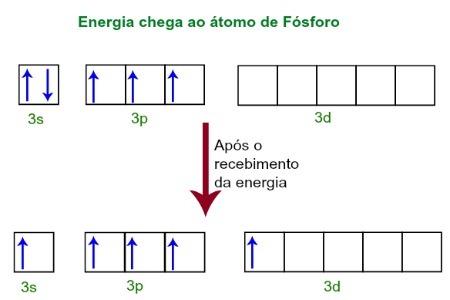
エネルギーを受け取ると、リン光物質の電子が励起され、dサブレベルの軌道を占有します。
現時点では、リンの原子価層にs軌道、3 p軌道、不完全なd軌道があります。最終的に、これらの5つの軌道は混成、つまり結合し、5つの不完全な原子軌道を生成し、5つの化学結合を作成できるようになります。

リンの不完全な原子軌道の混成
s軌道、3つのp軌道、およびd軌道が結合されたため、リン混成軌道は次のタイプになります。 sp3d。
私によって。DiogoLopesDias
学校や学業でこのテキストを参照しますか? 見てください:
DAYS、ディオゴロペス。 "リンの混成"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. 2021年6月28日にアクセス。