THE 塩橋 この学者が設立した1836年に英国の化学者フレデリックダニエルによって提案されました 電池 彼にちなんで名付けられました(Danill'sPile)。 この橋 は、2つの多孔質端を持つU字型のチューブです。 (綿または寒天からなる)そして水と塩によって形成された水溶液を含んでいます。 セルの2つの半電池(アノードとカソード)の溶液を間接的に接続します。
観察:アノードはバッテリーの負極であり、酸化が発生する場所であり、カソードは正極であり、還元が発生する場所です。
塩橋の重要性を理解するには、最初に杭の機能を理解する必要があります。 次の図を参照してください。
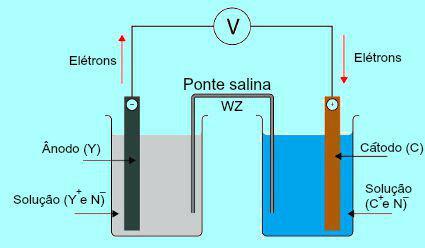
ダニエルスタックの一般的なスキーム
最初に、アノードに存在するプレートの金属(Y)が酸化されます。 酸化を受けると、金属は陽イオンに変わり、プレートが入っている溶液になります。 このため、アノード溶液はより高濃度のカチオン(Y+). この場合、陽極金属板の減少が観察されます。
Y→と- + Y+
次に、アノードプレートの金属の酸化中に失われた電子は、外部の電線を通って移動し、カソードに存在する金属プレートに行きます。 したがって、陰極に存在するプレートは電子で帯電するようになります。
-
現在の陽イオン(C+)溶液中は電子が帯電しているため、陰極板に向かって移動します。 陽イオンは、プレートに存在する電子を獲得すると、中性(安定して固体)になり、それに付着します。 このため、カソード溶液は陽イオンよりも陰イオンの濃度が高くなります。 この場合、陰極金属板のサイズの増加が観察されます。
今やめないで... 広告の後にもっとあります;)
Ç+ +および- →C
どのようにの理解から ダニエルの山、アノードに存在する溶液がより多くのYカチオンを受け取ることを観察することが可能です+ Xプレートの金属の酸化による。 一方、カソードに存在する溶液は、そのカチオンを失います(C+)プラークの減少に苦しんでいるからです。
塩橋の仕事が強調されているのはまさにこの問題です。 このブリッジの主な機能は、アノードとカソードの両方の溶液に存在する電荷のバランスを促進することです。 塩橋では、常に塩(通常は塩化カリウムまたは硝酸アンモニウム)が水中で解離しています。 塩橋の方程式の表現を参照してください。
WZ + H2O→W+ + Z-
塩橋には2つのイオンがあります(W+ およびZ-)、これは次のようにカソードとアノードにシフトされます。
) アノードは陰イオンを受け取ります(Z-)元素(Y)の酸化により塩橋に存在し、陽イオン(Y)の量が増加します。+)ソリューションで。
B) 陰極は陽イオンを受け取ります(W+)塩橋のバッテリー動作中、陽イオン(C+)ソリューションに存在するボード上で減少します。 したがって、カソード溶液はより多くの陰イオン(N-)したがって、塩橋に存在する陽イオンを受け取ります。
私によって。DiogoLopesDias
学校や学業でこのテキストを参照しますか? 見てください:
DAYS、ディオゴロペス。 "セイルブリッジ"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. 2021年6月28日にアクセス。


