THE 溶解度、または溶解係数、 それは、実験室で常に実際に決定される物質の物理的特性です。 それは、と呼ばれる材料が 溶質、別の、によって溶解されるプレゼント 溶媒.
溶解度に関しては、溶質は次のように分類できます。
解決策: 溶剤に溶けるもの。 たとえば、塩化ナトリウム(溶質)は水(溶媒)に溶けます。
やや溶ける: 溶剤に溶けにくいもの。 これは水酸化カルシウム[Ca(OH)の場合です2](溶質)水中;
不溶性物質: それらは溶剤に溶解しません。 たとえば、砂(溶質)は水に溶けません。
THE 溶解度 の準備に非常に関連しています ソリューション (均質な混合物)、なぜなら、溶液を得るためには、使用される溶質が溶媒に可溶であることが不可欠だからです。
溶解度に影響を与える要因
溶質が溶媒に溶ける場合でも、溶質の溶解能力に影響を与える可能性のあるいくつかの要因があります。 彼らは:
a)溶質と溶媒の量の関係
溶媒には、溶解できる溶質の限界が常にあります。 溶質の量を維持しながら溶媒の量を増やすと、溶媒は使用したすべての溶質を溶解する傾向があります。
B) 温度
温度は、特定の溶質に対する溶媒の溶解度を変更できる唯一の物理的要因です。 この変更は、以下に示すように、溶質の性質によって異なります。
吸熱溶質:溶媒が室温よりも高い温度にある限り、私たちがなんとかより大きな質量を溶解することができるものです。 溶媒が高温になるほど、溶質はより多く溶解します。
例: 水が熱いときに、より多くの挽いたコーヒーを溶かすことが可能です。
発熱溶質: 溶媒が室温よりも低い温度である限り、私たちがなんとかより大きな質量を溶解することができるものです。 溶媒が低温であるほど、溶質はより多く溶解します。
例: 炭酸飲料が冷えていると、より多くの二酸化炭素を溶かすことができます。
溶解度を決定する方法
溶解度は実験的な方法で決定された特性であるため、一般に、材料はほとんどの異なる溶媒ですでに溶解度が評価されています。 したがって、次のように特定の溶媒への溶質の溶解度にアクセスできます。
a)テーブルの分析
多くの場合、学生は表の解釈から溶解度に出くわすことができます。 次の例を参照してください。
例: (UEPG適合)以下の表は、Li塩の溶解度を示しています。2CO3 100グラムの水に。
今やめないで... 広告の後にもっとあります;)

表は、Liのグラム単位の質量値を示しています2CO3 これは、0から100グラムの水に溶解できます OCから50 OÇ。 水が熱くなるほど、Liが少なくなることがわかります2CO3 溶解します。 したがって、李2CO3 それは発熱性の溶質です(水が冷たい場合はより溶解します)。
b)グラフの分析
溶解度は、グラフを解釈することで評価できます。 これを行うには、温度を決定し、それを曲線に向けてから、曲線をy軸に向けます。これは、溶解する溶質のグラム単位の質量です。
例: (UFTM適合)グラフはAX塩の溶解度曲線を示しています2.
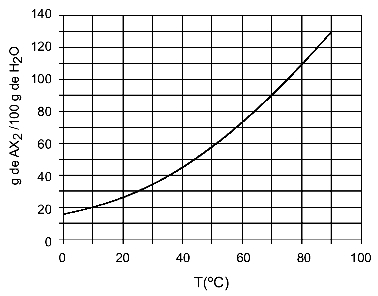
グラフは、y軸上で水(溶媒)の量が100グラムであることを示しています。 溶質AXの場合2、次の温度での水の量を決定します。
30OÇ: 温度をオンにすると30OCを曲線に、次に曲線をy軸にすると、この温度では、100グラムの水が約35グラムの溶質AXを溶解できることがわかります。2.
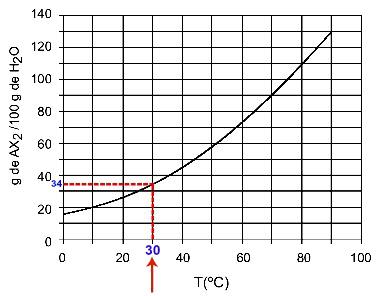
AX溶解度の決定2 30時OÇ
40OÇ: 温度をオンにすると40OCを曲線に、次に曲線をy軸にすると、この温度では、100グラムの水が約45グラムの溶質AXを溶解できることがわかります。2.
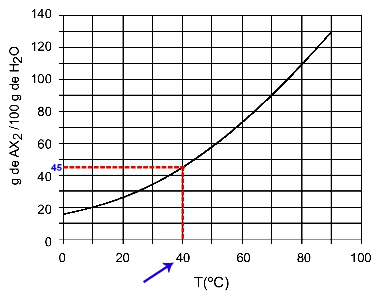
AX溶解度の決定2 40でOÇ
溶質の溶解量は温度が上がるたびに大きくなるため、AX2 それは吸熱溶質です。
c)テキストによる解釈
次の例を参照してください。
例: (PUC-MG)特定の物質は、他の物質と均一な混合物を形成することができます。 量が最も多い物質を溶媒と呼び、量が最も少ない物質を溶質と呼びます。 塩化ナトリウム(NaCl)は水と均一な溶液を形成し、20ºCで36gのNaClを100gの水に可溶化することができます。
テキストには、100グラムの水(溶剤)がある場合、20の温度であると記載されています OC、最大36グラムのNaClを溶解することが可能です。
私によって。DiogoLopesDias
学校や学業でこのテキストを参照しますか? 見てください:
DAYS、ディオゴロペス。 "溶解度とは何ですか?"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm. 2021年6月28日にアクセス。

