幾何異性体 一種です 空間異性 これは、鎖内の2つの炭素原子の配位子の空間内の位置を評価および比較します。 この評価は、関与する炭素間の仮想平面から行われます。
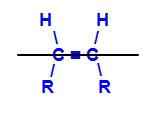
分子を分割する想像上の平面
上記の構造の仮想平面は、分子を上部平面と下部平面に分割します。 これにより、これらの各平面に含まれる炭素配位子を評価および比較できます。 幾何異性体の種類を参照してください。
→ シス-トランス幾何異性体
化合物は シス-トランス幾何異性 チェーンが表示されたとき:
互いに同じリンカーを持つ2つの炭素間に二重結合を持つ開鎖。 例を参照してください。
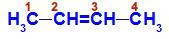
ブト-2-エンの構造式
この構造では、炭素2と炭素3の両方が同じ配位子、つまり水素(H)とメチル(CH)を持っていることがわかります。3).
互いに同じ配位子を持つ2つの炭素を持つ閉鎖。 例を参照してください。
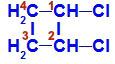
1,2-ジクロロ-シクロブタンの構造式
この構造では、炭素1と炭素2の両方が同じ配位子、つまり水素(H)と塩素(Cl)を持っていることがわかります。
シス-トランス異性を説明するために、but-2-eneを使用します。
a)シス異性体: 同じ配位子が同じ平面を占める幾何異性体です。 以下の例では、水素はメチルラジカルと同じ平面上にあります。

シス-ブト-2-エンの構造式
b)トランス異性体: は、異なる配位子が同じ平面を占める幾何異性体です。 以下の例では、同じ平面上に水素とメチル(CH3).
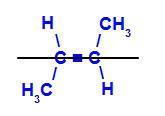
トランスブト-2-エンの構造式
今やめないで... 広告の後にもっとあります;)
→ E-Z幾何異性体
鎖が次の場合、化合物はE-Z幾何異性を持ちます。
すべてまたはいくつかの異なるリンカーを持つ2つの炭素間に二重結合を持つ開鎖。 例を参照してください。
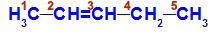
ペント-2-エンの構造式
構造では、炭素2がメチル配位子(CH)を持っていることがわかります。3)および水素(H)、および炭素3には水素(H)およびエチル(H)配位子があります3C-CH2).
すべてまたは一部の配位子が互いに異なる2つの炭素を持つ閉鎖。 例を参照してください。
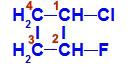
1-クロロ-2-フルオロ-シクロブタンの構造式
この構造では、炭素1が主な配位子として水素と塩素を持ち、炭素2が主な配位子として水素とフッ素を持っていることがわかります。
注意: さまざまな配位子の中で、幾何異性では、配位子の複雑さ(原子数)または原子番号を評価します。
E-Z異性体を説明するために、ペント-2-エンと1-クロロ-2-フルオロ-シクロブタンの両方を使用します。
a)E-異性体
幾何異性体 より複雑な配位子または最大の原子番号を持つ配位子が反対側の平面に配置されています。 次の例では、炭素2の最も複雑な配位子はメチルであり、炭素3の最も複雑な配位子はエチルであり、これらは異なる平面に配置されています。
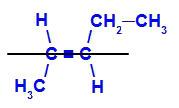
E-ペント-2-エンの構造式
b)異性体Z
幾何異性体 ここで、より複雑な配位子または最も高い原子番号を持つ配位子が同じ平面上に配置されます。 次の例では、炭素1の最大原子番号の配位子は塩素(Z = 17)であり、炭素2の最大原子番号の配位子はフッ素(Z = 9)であり、同じ平面に配置されています。
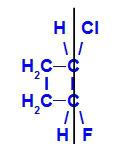
Z-1-クロロ-2-フルオロ-シクロブタンの構造式
私によって。DiogoLopesDias
学校や学業でこのテキストを参照しますか? 見てください:
DAYS、ディオゴロペス。 "幾何異性とは何ですか?"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-isomeria-geometrica.htm. 2021年6月28日にアクセス。
化学
機能、位置、鎖、互変異性、メタメリズム、シス-トランス幾何および光学異性など、さまざまなタイプの平面および空間異性体が何であるかを理解します。


