酵素 は、特定の化学反応の速度を上げる役割を担う生物学的触媒です。 酵素は通常 タンパク質、しかしいくつかあります リボ核酸 リボザイムと呼ばれる酵素として作用します。
反応を加速するために、酵素は基質として知られている試薬に結合しなければなりません。 長い間、このリンクは非常に厳格な方法で発生すると考えられていました。これは、キーロックと呼ばれるパターンです。 現時点では、 しかしながら、 誘導フィッティングとして知られるモデルが受け入れられます。、これは、基質が活性部位に入るときに酵素の形でわずかな変化が起こることを前提としています。
あまりにも読んでください: 代謝とは何ですか?
酵素とは何ですか?
酵素は、触媒として機能する生体分子です。 の速度を加速することができる物質 化学反応 これらの反応の間に消費されることなく生物で発生します。 酵素の作用がなければ、いくつかの反応は非常に遅くなり、代謝に害を及ぼします。 酵素は反応を選択的に加速するため、非常に特異的な触媒です。
酵素は、活性化エネルギーを減らすことによって反応をスピードアップすることができます。つまり、反応を開始するために追加する必要のあるエネルギーの量を減らします。
[publication_omnia]
すべての酵素はタンパク質ですか?
それらはしばしばタンパク質の性質の生物学的触媒として定義されていますが、 すべての酵素がタンパク質であるとは限りません。 リボザイムと呼ばれる酵素のように機能するRNAがいくつかあります。 しかし、ほとんどの酵素はタンパク質であり、したがって、によって形成されます アミノ酸. これらの生体分子のアミノ酸組成は、それが獲得する三次元構造を定義します。
あまりにも読んでください: 触媒物質はどのように機能しますか?
酵素-基質複合体
酵素が作用する試薬基質と呼ばれます。 酵素がその基質に結合すると、複合体が形成されます 酵素基質。 この結合は、活性部位と呼ばれる特定の領域で起こります。
タンパク質ベースの酵素について話すとき、活性部位はほんの数個のアミノ酸に対応し、分子の残りの部分が活性部位の構成を決定する役割を果たします。 活性部位の形状と基質の形状は、相補的でなければならないため、酵素の特異性に関連しています。
キーロックモデル
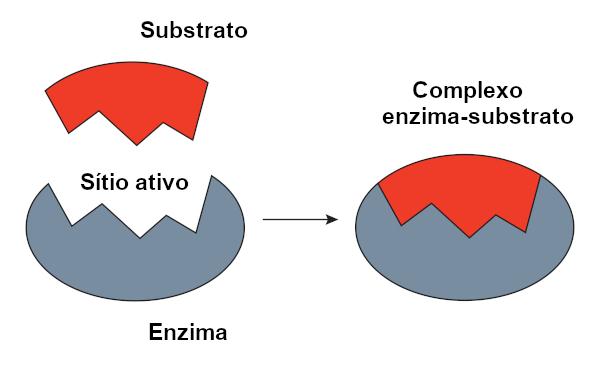
O キーロックモデルエミールフィッシャーによって提案された、酵素と基質の間の相互作用を説明するために広く使用されています。 このモデルによれば、キーとロックのように、酵素と基質の間には厳密な相補性があります。 酵素の活性部位は基質に対して相補的な形状を持ち、これは完全に適合します。 したがって、他の分子はこのサイトにアクセスできず、酵素の特異性が保証されます。 キーがロックだけを開くように、酵素は基質にのみ結合します。 しかし、今日、私たちはこれが モデルが正しくありませんなぜなら、酵素は以前考えられていたような堅固な構造ではないからです。
誘導フィッティングモデル
現在、 酵素とその基質の間のリンクを説明するための最も受け入れられているモデル の1つです スナップ 誘発、最初にコシュランドらによって提案された。 活性部位と基質は、キーとロックのように厳密には機能しません。 研究によると、基質が活性部位に入ると、酵素はわずかに修飾され、活性部位と基質の間の適合が促進されます。 このモデルをよりよく理解するために、酵素と基質の相互作用をハンドシェイクと考えることができます。ハンドシェイクは、最初の接触後に固くなります。
補因子
ほとんどの酵素は、補因子と呼ばれる触媒作用を実行するために補助分子を必要とします。 補因子は酵素に恒久的に付着するか、基質に弱く可逆的に付着する可能性があります。 彼らもまた 無機または有機にすることができます. 補因子が有機分子である場合、それらは呼ばれます 補酵素.
いくつか ビタミン 補酵素として作用します。これは、たとえば、ビタミンB2としても知られるリボフラビンの場合です。 無機補因子の例として、イオン形態の鉄と亜鉛に言及することができます。
あまりにも読んでください: ビタミンB複合体—一般的に補酵素として作用するビタミンのグループ
酵素分類
酵素は次のように分類できます 6つのグループ、それらが触媒する反応のタイプを基準として使用します。
オキシドレダクターゼ: の反応に関連する酵素 オキシル削減.
トランスフェラーゼ: ある化合物から別の化合物への基の移動を触媒します。
加水分解酵素: 加水分解反応を触媒します。
リアーゼ: 二重結合にグループを追加するか、二重結合を形成するグループを削除することによって機能します。
イソメラーゼ: 異性化反応を触媒します。
リンク: の分子の分解を引き起こす酵素 ATP、この反応で放出されたエネルギーを使用して新しい化合物を形成します。
酵素活性を調節する要因
酵素の活性は要因に影響されます。主な要因は温度と pH. 温度は一般に化学反応において正の役割を果たし、酵素反応の速度を高めます。 ただし、 温度 最適条件を超えて増加すると、反応速度は大幅に低下します。 これは、タンパク質の変性が観察されるためです。 ほとんどのヒト酵素の最適温度は35〜40°Cです。 温度に加えて、 pH 酵素活性にも影響を与え、最適値もあります。 ほとんどの酵素の場合、最適なpH値は6〜8の範囲です。
ヴァネッサ・サルディーニャ・ドス・サントス
生物学の先生
