活性異性体 または光学活性異性体(IOA)は、特定の化学物質の分子であり、偏光と偏差を実行できます。 の計画 光 右か左. 物質に活性異性体があるかどうかを確認するには、構造式に不斉炭素があるかどうかを確認します。

上の画像で表されているチェーンを分析すると、 中心炭素には4つの異なる配位子があります (OH、H、CH3 とCl)、それはそれを作ります 炭素 非対称、カーボンとも呼ばれます キラル. したがって、鎖に1つまたは複数のキラル炭素がある場合は常に、活性異性体が存在します。
君は 活性異性体の種類(IOA) 彼らです:
右利き: 偏光を右に曲げる活性光学異性体。
レボギロ: 偏光を左に曲げる活性光学異性体。
観察: 構造式に不斉炭素が存在することは、その物質が旋光性異性体と右旋性異性体を持っている必要があることを示しています。 キラル炭素の存在がすでにこの事実を証明しているので、光がどちらの方向に偏向されたかを知ることは私たちの責任ではありません。 常に既存の分子の半分は左巻きで、残りの半分は右巻きです。
有機物質の左巻きと右巻きの分子は常に同じ物理的性質を持っています( 融解、沸点、密度、溶解度など)が、化学的活性(生物の挙動)を示します 多くの異なる。 例はアドレナリンです。 アドレナリンの旋光性分子のみが体内で作用し、右旋性分子は作用しません。
今やめないで... 広告の後にもっとあります;)
ブタン-2-オール物質の構造式を参照して、活性異性体があるかどうかを確認してください。
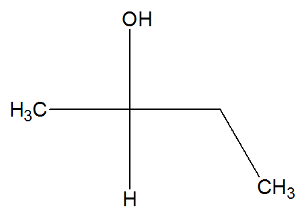
ブタン-2-オールの構造で、炭素2が持っていることを観察することができます 4つの異なるバインダー (OH、H、CH3、CH2-CH3)、それはキラル炭素であり、 右旋性活性異性体と別の左旋性活性異性体を提示します.
活性異性体(IOA)の計算
オランダの化学者 Jacobus Henricus van't Hoff 特定の物質が存在できる活性異性体(IOA)の数を計算できる式を開発しました。 見てください:
IOA:2番号
n: は、物質の構造式に含まれるキラル炭素の数です。
Vant'tHoff式の2つの適用例に従ってください。
5-ジクロロ-2,3-ジヒドロキシ-ヘキサン二酸

化合物の構造式には、3つあります キラル炭素 または非対称、したがって:
IOA = 2番号
IOA = 23
IOA = 8
2,3,4,5-テトラヒドロキシヘキサナール

化合物の構造式には、4つあります キラル炭素 (赤い矢印)または非対称、したがって:
IOA = 2番号
IOA = 24
IOA = 16
観察: 構造式には、まったく同じ配位子を持つ2つの不斉炭素が含まれている可能性があります。 これが発生した場合、計算ではnの値は2ではなく1のみと見なされます。 例を参照してください。
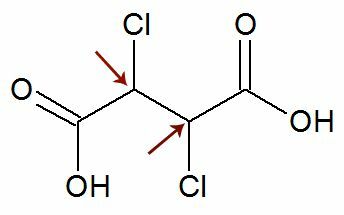
お気に入り 2つのキラル炭素 彼らです 等しい, 1つだけを考慮します 計算における炭素:
IOA = 2番号
IOA = 21
IOA = 2
私によって。DiogoLopesDias
学校や学業でこのテキストを参照しますか? 見てください:
DAYS、ディオゴロペス。 "活性異性体"; ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm. 2021年6月27日にアクセス。