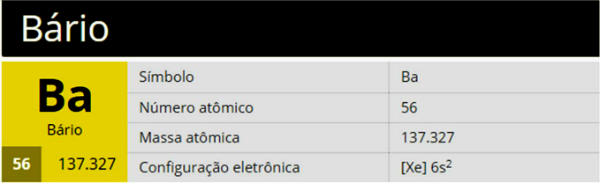
バリウムは、元素記号Ba、原子番号56、原子量137,327の化学元素で、周期表のグループ2(ファミリー2A)に属し、アルカリ土類金属です。
その名前はギリシャ語に由来します バリス そしてそれは重いことを意味します。
特徴
室温では、それは固体状態で見られ、柔らかな粘稠度と銀色をしています。 しかし、空気と接触すると容易に酸化されるため、自然界では純粋な形では見つかりません。
バリウムは重晶石鉱石(BaSO4)およびウィザライト(BaCO3). これらの鉱石の主な採掘地域は、英国、イタリア、チェコ共和国、米国、ドイツにあります。
バリウムは高融点(1000 K-727°C)と沸騰(2170 K-1897°C)を持っています。 それはまだ電気の良い導体です。
水やアルコールとの接触で非常に反応性があります。 水との反応により水酸化物が生成され、放出されます 水素.
可溶性バリウム化合物は体に有毒です。 水や食品に含まれているにもかかわらず、存在するバリウムの量は健康上の問題を引き起こすのに十分ではありません。
バリウムは酸化力が高いため、鉱油に保存する必要があります。
詳細については、以下もお読みください。
- 化学元素
- 周期表
アプリケーション
バリウムの主な用途には次のものがあります。
- 純粋な形では、電子バルブからの酸素除去に使用されます。
- 炭酸バリウムの形のラット毒;
- 塗料の白色顔料として使用されます。
- ガラス製造;
- 硫酸バリウムは、油井やガス井を掘削するための流体として使用されます。
- 塩素酸バリウムと硝酸塩は、花火のフレアの緑色の炎の生成に使用されます。
- 硫化バリウムは、消化器系のX線検査のコントラストを高め、患者に経口投与されます。 物質は不溶性であり、蓄積せず、体からすぐに排除されるため、摂取は健康上の問題を引き起こしません。
硫化バリウムは無害ですが、炭酸バリウムは非常に毒性が高く、致命的となる可能性があります。 酩酊状態の人は、呼吸困難、嘔吐、震え、頻脈、血圧上昇、唾液分泌があります。
あなたも興味があるかもしれません:
- 金属リンク
- 銅
- リチウム