拡散と流出 スコットランドの化学者トーマス・グラハムが19世紀に彼の研究に基づいて提案した2つの法律です。 ガス混合物 との動作 ガス コンテナの壁を通り抜けるとき。
拡散と浸出に関連するガスの挙動についてトーマス・グラハムが行った観察の中で、次のことを強調することができます。
ガスは常に、固体物質に存在する小さな穴を通過する傾向があります。
大きいほど 分子量 ガスは、固形物の穴を通過するのがより困難になります。
ガスの密度が低いほど、その移動速度は速くなります。
ガスがさらされる温度が高いほど、ガスが環境に拡散したり、オリフィスを通過したりする速度が速くなります。
- ガスが特定の場所で静止したままになることはありません。
拡散
拡散 これは、ガスが領域の空間全体またはコンテナ内に拡散する(つまり広がる)能力からなる物理現象です。 このため、空間内では、ガスが単一の場所に閉じ込められることは決してないと言えます。

放送の発生の表現
さらに、次のように定義できます。 拡散 同じ容器に入れられたときに、あるガスが別のガスと混合して均一なガス混合物を形成しなければならない容量であることに変わりはありません。
例としては、ガスが車両の排気ガスから出てくる場合があります。 それらは毒性がありますが、大気中に広がるため、人間に短期的な損傷を与えることはなく、その結果、濃度が低下します。
浸出
浸出 これは、特定のコンテナの壁にある穴をガスが通過することで構成される物理現象です。つまり、ある環境から別の環境へのガスの排出で構成されます。

溢れ出る発生の表現
例としては、パーティーのために風船を膨らませ、翌日、風船に含まれている穴から空気が逃げるために、風船がすべて収縮した場合があります。
拡散と浸出に関連する計算
グラハムによって提案された方程式に従って、ガスが実行する速度を計算することができます 拡散または浸出. グラハムによれば、コンテナ内で混合された2つのガスの拡散速度と流出速度は次のとおりです。 常に相対密度またはモル質量の2乗に反比例します。
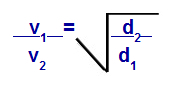
密度に関するグレアムの法則
v1 =混合物中のガス1の速度(流出または拡散)。
v2 =混合物中のガス2の速度(流出または拡散)。
d1 =混合物のガス1の密度;
d2 =混合物のガス2の密度;
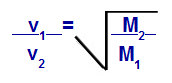
モル質量に関するグレアムの法則
v1 =混合物中のガス1の速度(流出または拡散)。
v2 =混合物中のガス2の速度(流出または拡散)。
M1 =混合物のガス1のモル質量;
M2 =混合物中のガス2のモル質量。
私によって。DiogoLopesDias
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-difusao-efusao.htm
