THE 化学反応速度論 は、化学反応の進行速度、つまり化学反応が起こる速度に影響を与える要因を研究する分野です。 私たちはしばしばいくつかの反応を速めたり、他の反応を遅くしたりしたいので、この分野の周りにはますます多くの研究があります。 これは産業にとって特に重要であり、この研究は重要な技術的結果をもたらします。
しかし、反応の速度は時間間隔ごとに、また物質ごとに異なる可能性があるため、通常、 平均反応速度.
次の一般的な反応について考えてみます。ここで、係数は小文字で、反応物と生成物は大文字で表されます。
a A + bB→cC + d D
この反応の平均速度が与えられます 反応物質のいずれかの平均反応速度または生成物のいずれかの平均形成速度を化学反応式のそれぞれの係数で割る。 これは次のように与えられます:
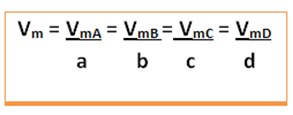
たとえば、過酸化水素分解反応について考えてみます。
2時間2O2(aq) →2H2O(1) + 1 O2(g)
1分で0.3mol / LのHが生成されたとしましょう2Oおよび0.15mol / LのO2、0.3 mol / LのHが分解している間2O2つまり、反応におけるこれらの物質の平均分解速度と形成速度は次のとおりです。
VmH2O2 = 0.3 mol / L。 最小
VmH2O = 0.3 mol / L。 最小
VmO2 = 0.15 mol / L。 最小
グローバル反応の平均速度は、これらの値の1つを取り、それを方程式のそれぞれの係数で割ることによって求められます:
Vm = VmH2O2 = 0.3mol / L。 最小 = 0.15mol / L。 最小
2 2
Vm = VmH2O = 0.3mol / L。 最小 = 0.15mol / L。 最小
2 2
Vm = VmO2 = 0.15mol / L。 最小 = 0.15mol / L。 最小
1 1
3つの値は等しいため、反応速度は同じ時間間隔での反応物または生成物の関数と同じであることに注意してください。
しかし、これらの反応に関与する各物質の平均速度の値はどのように見つかりましたか?
計算できます 物質(試薬または製品)の濃度の変動を時間間隔で除算します。 いずれかの平均速度を決定する場合 試薬 反応の、私たちは置く必要があります 負の符号 前に、または濃度値を考慮する モジュール内||、 なぜなら、反応物の濃度は時間とともに減少するため、速度値は負になりますが、負の速度はありません。

たとえば、次のオゾンガス分解反応(O3(g))酸素ガス中(O2(g)):
2 O3(g) →3O2(g)
気球の中に10モルのオゾンガスがあったが、1分後には4モルしか残っていなかったとしましょう。 これは、6モルのオゾンが酸素ガスに変わったことを意味します。 だから私たちは持っています:
2 O3(g) →3O2(g)
t = 0分2mol / L 0 mol / L
形成された費用
6 mol / L 9 mol / L
t = 1分4mol / L 9 mol / L
反応比が2:3であるため、6モルのOを使用した場合は注意してください。3、9molのOが形成された2. したがって、1分後、次の平均速度になります。
Vm = - ∆ [3]
t
Vm = -([O3ファイナル- O3イニシャル])
t最後の -t初期
Vm = - ([4 - 10])
1– 0
Vm = 6mol / L。 最小→1分間、システム1リットルあたり6molのオゾンが反応しました。
Vm = ∆ [2]
t
Vm = ([O2ファイナル- O2イニシャル])
t最後の -t初期
Vm = ([9 - 0])
1– 0
Vm = 9 mol / L。 最小→1分間で、システムの1リットルあたり9モルの酸素が生成されました。
これは、反応物の関数または生成物の関数として平均速度を計算できることを示しています。
ここで、このグローバル反応の平均速度を計算する場合は、最初に示したように実行します。これらの各速度を化学反応式のそれぞれの係数で除算します。
Vm = VmO3 = 6mol / L。 最小 = 3mol / L。 最小
2 21
Vm = VmO2 = 9mol / L。 最小 = 3mol / L。 最小
3 3
Vm = VmO3 = VmO2
23
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/velocidade-das-reacoes-quimicas.htm
