たとえば、酢やビスケットなどの多くの医薬品や液体および固体の食品では、 溶質の質量パーセントでの含有量(m1)溶液全体の質量に関連して(m = m1 + m2). この大きさは タイトル(T)または質量パーセント ソリューションの。
その定義は次のように表すことができます。

したがって、その計算は以下の数式を介して行われます。
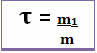
または

分母と分子の両方が同じ単位を扱っているため(質量の単位はグラム-g)、タイトルには単位がなく、1未満です。
したがって、与えられた溶液のタイトルが0.4であると言う場合、それは、溶液の質量の単位ごとに、0.4が溶質の質量に対応することを意味します。 ただし、タイトルは多くの場合、パーセンテージで表されます。 これを行うには、見つかった値に100%を掛けるだけです。 この場合、それはと呼ばれます 質量パーセント(T%) *
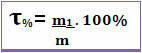
下の図に注意してください。ここでは、生理食塩水中の塩化ナトリウムの質量パーセントが示されています。

脱水症の治療に使用される生理食塩水は、0.9%の塩化ナトリウムの質量パーセントを含んでいます
この場合、この溶液の100 gまたは100単位ごとに、0.9 gまたは0.9%の溶質、つまり塩化ナトリウム(NaCl –食卓塩)が存在することを意味します。
別の例は酢です。そのラベルには、酢酸の質量の5%がその調製に使用されたことが示されています。つまり、100gの溶液ごとに5gのこの酸があります。

タイトルはで与えることもできます 体積分率. この場合、唯一の違いは、溶質の質量を溶液の質量に関連付ける代わりに、 溶質の体積は、次の式に従って、溶液の体積に関連しています。
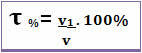
たとえば、体積パーセントが96%の通常のアルコールの場合、100mLの溶液では96mLがアルコールです。

*「タイトル」という用語は科学者の間でより頻繁に使用されますが、技術者や数人の本の著者は「質量パーセント」という表現をより頻繁に使用します。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/titulo-ou-porcentagem-massa.htm
