あ 熱力学の第二法則 どのような条件が存在するかを決定します 熱 熱機関や冷蔵庫での仕事に変換されます。 の定義にも言及します。 エントロピ 物理システムにおける粒子の無秩序を測定できる現象として。
こちらもお読みください: 熱量測定 — 熱交換を研究する物理学の分野
熱力学第二法則のまとめ
熱力学の第 2 法則は、クラウジウスとケルビン プランクのステートメントによって表されます。
クラウジウスの声明は、熱い体から冷たい体への熱の流れを扱っています。
ケルビン・プランクの声明は、熱デバイスがすべての熱を熱に変換できないことに言及しています。 仕事.
熱力学の第 2 法則は、熱機関と冷蔵庫に適用されます。
カルノー サイクルは、熱機関によって得られる最大効率サイクルです。
カルノー サイクルには、可逆的等温膨張、可逆的断熱膨張、可逆的等温圧縮、可逆的断熱圧縮の 4 つの段階があります。
カルノーの定理は次の収量を指します。 カルノーマシン.
熱力学の第二法則とは何ですか?
熱力学の第二法則は、 熱力学的プロセスで発生する制約に対処する法則. これは、以下に示すように、物理学者のルドルフ クラウジウス (1822 ~ 1888 年)、ケルビン卿 (1824 ~ 1907 年)、およびマックス プランク (1858 ~ 1947 年) によって宣言されました。
物理学者で数学者のルドルフ・クラウジウスは、高温の物体から低温の物体への熱の伝導流が発生すると述べました。 温度が低いと逆の過程が起こるのは自然ではないので、これについての作業を行う必要があります。 システム。 その上で、彼はこう述べた。
より冷たい物体からより熱い物体へ熱を伝達することだけが効果となるプロセスを実行することは不可能です。|1|
ケルビン卿として知られる数理物理学者ウィリアム・トムソンと物理学者マックス・プランクの貢献により、 100%の効率を持つ熱デバイスは不可能であると述べた常に熱損失が発生するためです。
熱力学第 2 法則の応用
熱力学の第 2 法則は、熱機関と冷蔵庫に適用されます。
機械における熱力学の第二法則 熱の
へ サーマルマシン 熱を仕事に変換することができます。 高温源は熱機関に熱を供給し、熱機関が熱を仕事に変えます。 以下の図に示すように、残りの熱は低温源に送られます。
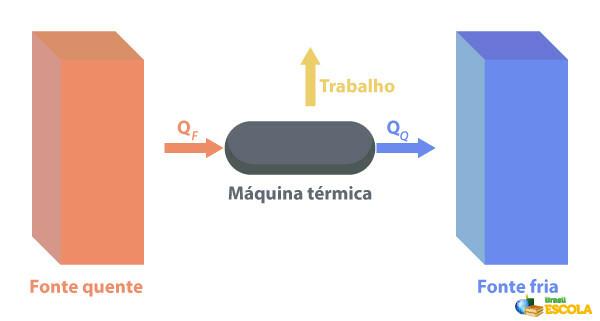
熱機械の例としては、ジェット機の蒸気タービンや灯油タービン、燃焼エンジン、熱核融合炉などがあります。
冷蔵庫の熱力学第二法則
冷蔵庫は次のような機械です。 熱機関とは逆の働きをします。、そこで領域から熱を除去します。 温度 温度を下げて温度の高い地域に供給します。 これは自然ではないため、次の図に示すように、機械は電気エネルギーを使用して作業を実行する必要があります。
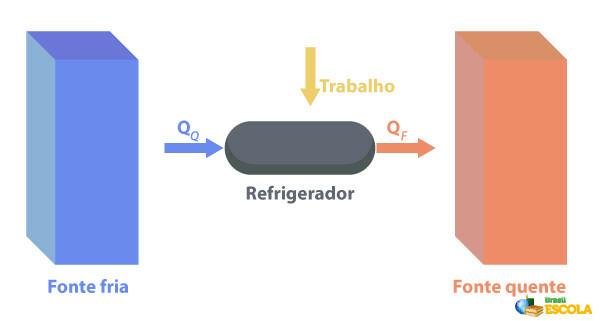
冷蔵庫の例としては、冷蔵庫やエアコンがあります。
エントロピーと熱力学第二法則
あ 熱力学第二法則はエントロピーの存在を提案します、 一 物理量 物理系における粒子の崩壊の程度、または粒子の不可逆性の程度を測定する責任を負います。 熱機関に関与する熱力学的プロセス。自発的、必然的、不可逆的であり、 広大な。 これにより、プロセスの不安定性の程度を観察して抑制することのみが可能になります。 エントロピーが増加すると、システム内の無秩序の程度も増加します。
あ エントロピー命名法はギリシャ語に由来し、「変換」を意味します。、「変化する」という意味で使われます。 物理的 ランダム性と無秩序性を示します。 エントロピーは次の式を使用して計算できます。
\(∆S=\frac{∆U}T\)
\(ΔS\) はエントロピー変化であり、[J/K] で測定されます。
\(ΔU\) は内部エネルギーの変化であり、ジュール [J] で測定されます。
T は温度であり、単位はケルビン [K] です。
統計的な観点から、エントロピーは次の式で計算されます。
\(S=k\cdot ln\ Ω\)
S はエントロピーであり、単位は [J/K] です。
k はボルツマン定数であり、値があります \(1,4\cdot 10^{-23}\ J/K\).
Ω は、システムで可能なマイクロステートの数です。
こちらもお読みください: 熱伝播プロセス
熱力学第二法則の公式
熱機械および冷蔵庫
\(Q_Q=W+Q_F\)
\(Q_Q\) ジュール [J] で測定される熱源の熱です。
W は熱機関によって行われる仕事で、単位はジュール [J] です。
\(Q_F\) 冷熱源からの熱であり、単位はジュール [J] です。
それは次のように表すことができます。
\(W=Q_Q-Q_F\)
W は熱機関によって行われる仕事で、単位はジュール [J] です。
\(Q_Q\) ジュール [J] で測定される熱源の熱です。
\(Q_F\) 冷熱源からの熱であり、単位はジュール [J] です。
冷蔵庫
\(η=\frac{Q_F}{Q_Q-Q_F}\)
\(η\) 冷蔵庫の効率です。
\(Q_F\) 冷熱源からの熱であり、単位はジュール [J] です。
\(Q_Q\) ジュール [J] で測定される熱源の熱です。
これは次のように表すことができます。
\(η=\frac{Q_F}W\)
\(η\) 冷蔵庫の効率です。
\(Q_F\) 冷熱源からの熱であり、単位はジュール [J] です。
W は熱機関によって行われる仕事で、単位はジュール [J] です。
例 公式の適用について
例 1: 高温源から 500 J の熱を受け取り、低温源に 400 J の熱だけを伝達するサイクル中に熱機関が行う仕事を計算します。
熱機関の仕事を計算するには、次の式を使用します。
\(W=Q_Q-Q_F\)
ステートメントに示されている値を代入すると、次のようになります。
\(W=500-400\)
\(W=100\ J\)
熱機関の仕事量は 100 ジュールでした。
例 2: 高温源から 150 J の熱を受け取り、50 J の熱を低温源に伝達する冷蔵庫の効率はどれくらいですか?
冷蔵庫の効率を計算するには、次の式を使用します。
\(η=\frac{Q_F}{Q_Q-Q_F}\)
ステートメントで指定された値を置き換えると、次のようになります。
\(η=\frac{50}{150-50}\)
\(η=\frac{50}{100}\)
\(η=0,5\)
収量に 100% を乗算すると、次のようになります。
\(η=0.5\cdot100%\)
\(η=50\%\)
冷蔵庫の効率は50%です。
カルノーサイクル
カルノーサイクルは、 科学者サディ・カルノー (1796-1832) によって開発されました。、高温源と低温源の間で動作する熱機関が達成できる最大効率を特定することを目的としています。
カルノーは研究に基づいて、熱機関から最大の効率を得るには、 彼のプロセスが可逆的であるためには必要であるため、彼はサイクルと呼ばれる最大収量サイクルを開発しました。 カルノーと、 それを介して機能する熱機関はカルノー熱機関と呼ばれます。. カルノーサイクルは可逆なので、逆に回すことができ、そうして冷蔵庫が開発されました。
カルノー サイクルは、使用される物質に関係なく、以下の図に示すように、体積に対する圧力 (p×V) のグラフで表される 4 つのプロセスで構成されます。
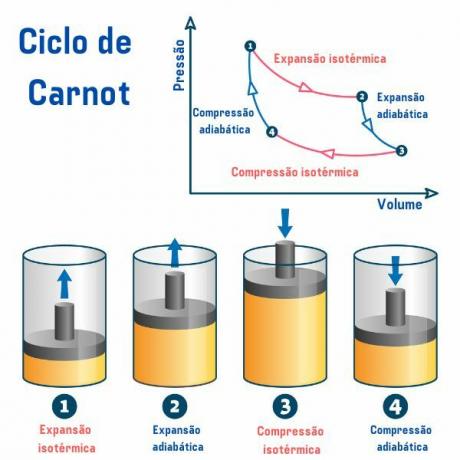
第一工程 ポイント1→2: 可逆的な等温膨張 (温度が一定に保たれるプロセス) があり、ガス (またはシステム) が働き、高温源から多量の熱を取得します。
第2工程 ポイント2→3: 熱の交換が存在しない可逆的な断熱膨張(外部環境との熱交換が行われるプロセス)が存在します。 熱源で熱を与えますが、ガスは機能し、その内部エネルギーが減少し、その結果、 温度。
第3工程 ポイント3→4: 可逆的な等温圧縮が発生し、ガスが仕事を受け取り、ある量の熱を低温源に放出します。
第4工程 ポイント4→1: 可逆的な断熱圧縮が発生し、熱源との熱交換は起こらず、ガスは 熱源の温度に達するまで加熱され、熱源と接触して配置され、熱源の温度が終了します。 サイクル。
熱力学の法則
熱力学の法則は、熱力学の研究全体を支配する 4 つの法則です。 熱力学、体積、温度、圧力と、熱やエネルギーなどの他の物理量との関係を学びます。
熱力学の第 0 法則: の法則です 熱平衡、温度の異なる物体間の熱交換を研究します。
熱力学の第一法則: 熱力学システムにおけるエネルギー保存の法則であり、熱が仕事や内部エネルギーに変換されることを研究します。
熱力学の第二法則: それは熱機関、冷蔵庫、エントロピーを扱う法則です。
熱力学の第三法則: の法則です 絶対零度、彼女はこの温度の影響を研究しています。
こちらも読んでください: 熱機関の性能
熱力学の第 2 法則に関する演習を解決しました
質問1 カルノー エンジンの高温源の温度を決定します。低温源の温度は 450 K、効率は 80% であることがわかっています。
a) 2250K
b) 450K
c) 1500K
d) 900K
e) 3640K
解決:
代替案 A. カルノー エンジンの効率式に基づいて熱源の温度を計算します。
\(η=1-\frac{T_F}{T_Q} \)
\(80 \%=1-\frac{450}{T_Q} \)
\(\frac{80}{100}=1-\frac{450}{T_Q} \)
\(0,8=1-\frac{450}{T_Q} \)
\(0,8-1=-\frac{450}{T_Q} \)
\(-0,2=-\frac{450}{T_Q} \)
\(0,2=\frac{450}{T_Q} \)
\(T_Q=\frac{450}{0,2}\)
\(T_Q=2250\ K\)
質問2 (Cefet-PR) 熱力学の第 2 原理は次のように言えます。 サイクルで動作する熱エネルギー。その唯一の効果は熱源から熱を除去し、それを統合的に熱エネルギーに変換することです。 仕事"。 拡張すると、この原則は次のような結論に導きます。
a) 効率が 100% の熱機械を構築することは常に可能です。
b) 熱機関は熱源を 1 つだけ必要とします。
c) 熱と仕事は均一な量ではありません。
d) 熱機関は、高温源から熱を引き出し、その熱の一部を低温源に排出します。
e) 常に 0 °C に維持された冷熱源を使用した場合のみ、特定の熱機関が熱を完全に仕事に変換することが可能になります。
解決:
代替案 D. この原理は、高温源からすべての熱を除去して低温源に伝達することは不可能であることを示しています。
ノート
|1| 基礎物理コース: 流体、振動と波、熱 (vol. 2).
パメラ・ラファエラ・メロ著
物理教師
ソース: ブラジル学校 - https://brasilescola.uol.com.br/fisica/segunda-lei-da-termodinamica.htm
