君は ガス 彼らです 流体 液体とは異なり、それはそれらが閉じ込められている容器の利用可能なすべてのスペースを占めます。 ガスを構成する分子は自由に動き、互いに、そして容器の壁と相互作用します。
O 完璧または理想気体 それは理想化されたガスであり、特定の特性を持ち、 一般気体の法則 そしてその クラペイロンの方程式。
完全ガスの特性
存在しない 重力相互作用 分子間;
で 衝突 分子の中には 完全に弾力性つまり、運動エネルギーが完全に保存されます。
分子は無秩序な動きを示し、 ガス温度値に直接依存する速度;
各分子の適切な体積は、ガスの総体積と比較して完全に重要ではありません。
状態変数
圧力, 温度 とボリュームは スカラー物理量 それはガスを特徴づける。 これらの量は状態変数と呼ばれ、次の関係を維持します。 比例性.
THE ボイルの法則ガスの圧力と体積の関係が反比例することを決定します。 分子への圧力が大きいほど、分子が占めるスペースは少なくなります。
THE ゲイ・リュサックの法則ガスの体積と温度の関係が正比例することを決定します。 ガスの温度が高いほど、分子の攪拌が大きくなり、分子が離れる傾向があり、分子が占めるスペースが増加します。
シャルルの法則 ガスの圧力と温度の関係が正比例することを決定します。 ガスの温度が高いほど、分子の攪拌が大きくなります。 したがって、分子と容器の壁との間の衝突の発生率が増加し、ガスの圧力が高くなる。
THE クラペイロン方程式 上記の3つの法則を統合し、状態変数間の単一の関係を決定します。
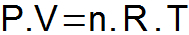
P = ガス圧(atmまたはN / m2);
V = ガス量(Lまたはm3);
n = モル数;
R = ユニバーサルガス定数(0.082 atm.l / mol。 Kまたは8.31J / mol。 K);
T = ガス温度(K)。
自然界の理想気体
自然は完全気体の特性を持つ気体を生成しません。 理想気体は、特性の変化に直面した気体の挙動を理解するための理論的で有用なモデルです。
JoabSilas著
物理学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/o-que-e/fisica/o-que-e-gas-perfeito.htm
