反応の動的平衡または化学平衡は、順方向と逆方向の反応が同時に発生したときに発生します。 これらのいわゆる可逆システムは、両方向の矢印で表されます。  または
または  . 上の画像では、ヨウ素ガスと水素ガスの間の可逆反応の例が引用されています。
. 上の画像では、ヨウ素ガスと水素ガスの間の可逆反応の例が引用されています。
反応の開始時に、反応物の量は最大であり、生成物の量はゼロです。 しかしながら、反応物は互いに反応し、それらの濃度を減少させ、形成された生成物の濃度を増加させる。 直接反応の発生率も低下しています。
生成物の濃度が増加すると、逆反応が始まり、反応物が再び形成されます。 逆反応の発生率も増加します。
一定の温度で化学平衡に達すると、順方向反応と逆方向反応の発生速度は等しくなります。
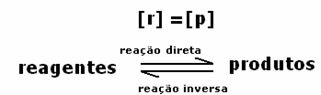
すべて直接 =すべて 逆
率は同じですが、濃度は異なります。 試薬と生成物の濃度が同じになる可能性は低いです。 まれなケースでのみ、これが発生します。 ほとんどの場合、試薬の濃度は製品の濃度よりも高くなり、その逆も同様です。
したがって、の開発率をグラフィカルに表す3つの可能な方法があります。 直接および逆反応、反応物および生成物の濃度を 時間。 それぞれのケースを見てみましょう:
1番目のケース: 等しい濃度:
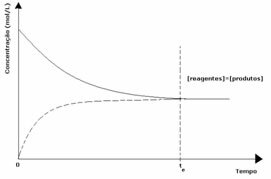
グラフに見られるように、時間tでそして 順方向反応と逆方向反応は同じです。この場合、反応物と生成物の濃度は同じです。 したがって、バランスはどちらの側にもシフトせず、以下に示すように、両方の反応の強度は同じです。
2番目のケース: 製品の濃度よりも高い試薬の濃度:
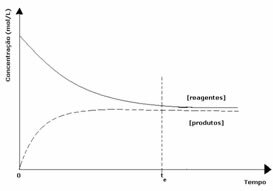
この場合、平衡に達すると、反応物の濃度が生成物の濃度よりも高くなることが観察されます。 したがって、より多くの反応物が存在する場合、逆反応がより強い強度で起こっていると結論付けられる。 反応は左にシフトします:
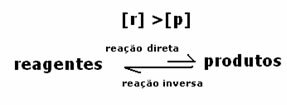
3番目のケース: 試薬よりも高い生成物の濃度:
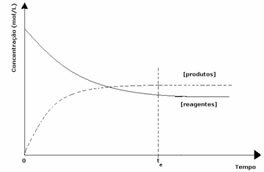
平衡状態では生成物の濃度が高いため、これは反応が 直接反応(生成物の形成を伴う)がより大きく発生するため、右にシフト 強度。
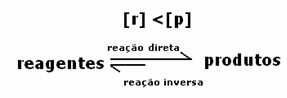
反応が右に向かうか左に向かうかを示すのは、温度のみに依存する平衡定数Kです。
ジェニファー・フォガサ
化学を卒業
ブラジルの学校チーム
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/estudo-grafico-equilibrio-quimico.htm
