THE オクテット理論 化学元素の原子が安定するためには、希ガスの電子配置を取得する必要があると述べています。 つまり、原子が最初の電子殻しかない場合は、価電子殻に8個の電子、または2個の電子が必要です。 (K)。
ベリリウムの原子番号は4です。 したがって、原子には4つの電子があり、基底状態でのその電子分布は次の式で与えられます。

ベリリウムの電子配置
これは、ベリリウムの最後のシェルに2Aファミリー(アルカリ土類金属)の2つの電子があることを意味します。 したがって、これらの2つの電子を供与して、電荷2+を取得する傾向があります。つまり、イオン結合を形成する傾向があります。
ただし、ベリリウム原子は、以下に形成される化合物である水素化ベリリウム(BeH)に示すように、電子を共有して共有結合を実行することが観察されています。2):
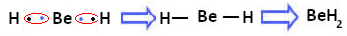
ベリリウムと水素の共有結合の形成
この場合、ベリリウムは価電子が8未満で安定していることに注意してください。これは、 水素原子のように電子を共有し、最後に4つの電子を持っています 層。 したがって、それは オクテット則の例外.
しかし、共有結合は通常、元素の軌道が不完全であるために発生します。 たとえば、以下に示すように、水素の軌道は不完全であるため、共有結合は1つしか作成されません。 酸素には2つの不完全な軌道があり、2つの共有結合を形成します。 次に、窒素は3つの不完全な軌道を持ち、その結果、3つの共有結合を形成します。
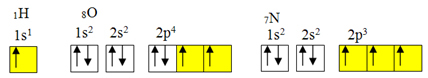
水素、酸素、窒素の電子分布
ただし、すでに示したように、ベリリウムには不完全な軌道はありません。
では、なぜそれが共有結合を作るのでしょうか?
説明はにあります ハイブリダイゼーション理論、それはそれを言います 軌道からの電子がエネルギーを受け取ると、それは最も外側の空の軌道に「ジャンプ」します。 励起状態にとどまるため、不完全な原子軌道の融合または混合が発生します。 生成 ハイブリッド軌道 これらは互いに同等であり、元の純粋な軌道とは異なります。
たとえば、ベリリウムの場合、サブレベル2sからの電子はエネルギーを受け取り、空のサブレベル2p軌道に渡されます。

ハイブリッド軌道の形成のためのベリリウム励起状態
このように、ベリリウムには2つの不完全な軌道があり、2つの共有結合を作ることができます。
一方の軌道は「s」サブレベルにあり、もう一方は「p」にあるため、ベリリウムが実行するバインディングは異なる必要があることに注意してください。 しかし、これは何が起こるかではありません。
ハイブリダイゼーション、形成されたこれらの不完全な軌道は混合し、次の2つの軌道を生成します。 ハイブリッド または ハイブリダイズ、互いに等しい。 さらに、これらの2つの混成軌道は、「s」軌道と「p」軌道に由来するため、この混成軌道は次のタイプであると言えます。 sp:
ベリリウムspハイブリダイゼーション形成
ハイブリッド軌道は同じであるため、ベリリウムが水素原子と作る共有結合も同じになります。

ハイブリッドベリリウム軌道と水素のs軌道との相互貫入
次に、タイプs-sp(σ)の2つのシグマ結合を作成することに注意してください。s-sp).
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/hibridizacao-berilio.htm
