一定温度での次の化学平衡を考慮してください。
3時間2(g) + N2(g) ↔2NH3(g)
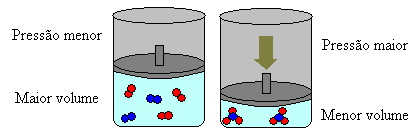
ゲイ・リュサックによれば、反応におけるガス状の参加者の体積の比率は、それぞれの化学量論係数の比率に等しい。 簡単に言えば、反応物と生成物に存在する分子の数は、方程式の係数に等しいと言えます。
上記の場合、試薬には4つの分子があり、製品には2つの分子があります。これは、試薬の体積が大きく、生成物の体積が小さいことを意味します。
このシステムの圧力を上げると、バランスはより小さな体積にシフトし、この圧力を下げます。 私たちが検討している反応の場合、変位は生成物形成の直接方向になります(NH3(g)).
ただし、圧力を下げると、反応は反応物の形成の最大体積、つまり反対方向に移動します(3 H2(g) + N2(g)).
これは、ルシャトリエの原理に従って発生します。この原理では、障害(圧力の増減など)が発生すると 平衡状態にあるシステムでは、この外乱を最小限に抑える方向に移動し、新しいシステムに再調整します。 残高。
簡単に言えば、化学平衡に対する圧力変動の影響の場合、次のように言うことができます。
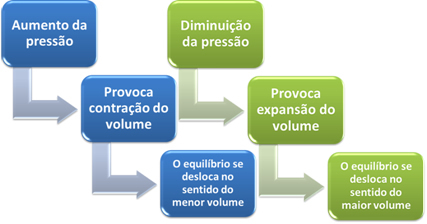
反応物の体積が生成物の体積に等しい反応の場合、化学平衡は変化しません。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/variacao-pressao-deslocamento-equilibrio-quimico.htm

