可逆反応は通常、一定量の試薬から始まります。 直接反応が始まると、時間の経過とともに、これらの試薬は形成のために消費されます その結果、試薬の濃度は低下しますが、生成物の濃度は低下します。 増加します。 次に、逆反応も開始し、直接反応と逆反応の発生速度(速度)が同じままになるまで反応物も生成し、いわゆる 化学バランス.
平衡状態では、平衡定数Kcがあり、これは基本的に次の式で表されます。
|
Kc = 【商品】【商品】バランスの取れた化学反応式の係数 【試薬】バランスの取れた化学反応式の係数 |
つまり、次の一般的な平衡反応を考慮します。
a A +bB↔cC+ d D
小文字は係数であり、大文字は物質であるため、この反応の平衡定数は次のようになります。
Kc = [Ç]ç. [D]d
[THE]ザ・. [B]B
これについての詳細はテキストで見ることができます 平衡定数KcおよびKp. このテキストはまた私たちに重要な何かを示しています:Kc値は試薬の濃度と 生成物が等しいか、一方が他方よりも大きい場合、およびその結果、化学物質のバランスが 反応。
したがって、Kcの値を決定する必要があります。 これを行うには、これらの計算は実験的なものであることに注意してください。そこで、反応のいくつかの例とそれらから得られたデータを見てみましょう。
これらの計算を実行するのに非常に役立つことは、以下に示すようなテーブルを作成し、そこに記載されている手順に従うことです。

平衡定数の計算に使用されるデータを整理するための表
それでは、練習に行きましょう。
例1: 容量2Lの密閉容器内、100°Cの温度で、20molのNが存在します2O4. 次の可逆反応が起こり始めます:N2O4 ↔いいえ2. しばらくすると、反応が化学平衡に達し、8molのNOが2 形成されていた。 100°Cの温度での平衡定数Kcの値は何ですか?
解決:
テーブルを使用してみましょう:

平衡定数の計算例を解くために使用されるテーブル
反応して形成する量が書かれた行では、4モルのNが費やされたことがわかっていることに注意してください2O4、比率が1:2であり、8molのNOが形成されたため2.
ここで、この反応の平衡定数Kcの式にある値を置き換えるだけです:
Kc = [で2]2
[N2O4]
Kc = (4 mol / L) 2
(8 mol / L)
Kc = 2 mol / L
Kcの値は無次元であり、大きさに関係する単位はありません。
それでは、最初から製品も含まれている例を見てみましょう。
例2: 容量5Lの密閉容器内に、温度Tで、2モルの水素ガス、3モルのヨウ素ガス、および4モルのヨウ化水素があります。 反応は温度Tで化学平衡に入り、容器内に1モルの水素ガスがあることがわかります。 この平衡を表すグラフは何ですか?また、Tの温度での平衡定数Kcの値は何ですか?
解決:
テーブルの使用:
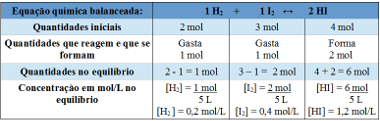
平衡定数を決定するために使用されるテーブル
平衡に達するまでの試薬と生成物のmol / L濃度の変化を示すグラフは次の式で与えられます。

試薬と生成物の濃度の変化を示す化学平衡グラフ
ここで、平衡定数の値を発見します。
Kc = __ [HI]2__
[H2 ]. [私2]
Kc = (1,2)2
0,2. 0,4
Kc = 18
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/calculo-constante-equilibrio-kc.htm
