その名前が示すように、イオン結合はイオン間で発生します。 それらは反対の電荷を持っているので、陽イオン(正の電荷を持つ要素)と陰イオン(負の電荷を持つ要素)は互いに静電的に引き付け合い、結合を形成します。 ただし、イオン性固体は、格子または結晶格子と呼ばれる明確に定義された幾何学的形状で編成された陽イオンと陰イオンの凝集体で構成されています。
たとえば、塩(塩化ナトリウム)は、ナトリウムから塩素への電子の確実な移動によって形成され、ナトリウムカチオン(Na+)および塩化物アニオン(Cl-). 実際には、この反応には2つの原子だけでなく、以下に示すように、立方体の結晶格子を形成する膨大な数の不確定な原子が含まれます。
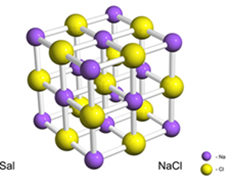
走査型電子顕微鏡で塩の結晶を見ると、内部構造のために実際には立方体であることがわかります。

すべてのイオン性化合物は不確定で非常に多数のイオンで構成されているので、イオン性化合物をどのように表すことができますか?
通常使用される式は 単位式、それは 化合物の総電荷が中和されるように、結晶格子を構成する陽イオンと陰イオンの可能な最小数で表される比率を表します. これが発生するためには、原子によって放棄された電子の数が、他の原子によって受け取られた電子の数と等しい必要があります。
イオン性化合物の単位式に関するいくつかの側面が重要です。いくつかを参照してください。
- 常に最初に陽イオンを書き、次に陰イオンを書きます。
- すべてのイオン性化合物は電気的に中性であるため、個々のイオン電荷を書き留める必要はありません。
- 各イオンの右側に表示される下付き文字の番号は、陰イオンに対する陽イオンの原子の比率を示しています。 これらの番号はインデックスと呼ばれ、番号1は書き込まれません。
たとえば、塩化ナトリウムの場合、塩化物アニオンごとに正確に1つのナトリウムカチオンがあるため、その単位式はNaClになります。
別の例、Alを参照してください3+ Fは3つの正電荷を持っています- ネガティブは1つしかないため、化合物を中和するには3つのフッ化物アニオンが必要です。 したがって、その単位式はAlFであると結論付けます。3.
イオン性化合物の単位式に到達する簡単な方法は、以下の一般的な方法で示すように、その電荷をそのインデックスと交換することです。
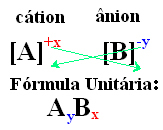
例:

イオン性物質を表すために使用される別の式は、 ルイス式 または 電子式、 何 元素記号の周りの「ボール」イオンの価電子を表します。 塩の場合、次のようになります。

ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/formulas-para-representar-as-ligacoes-ionicas.htm
