以下の一般的な可逆反応について考えてみます。ここで、小文字は平衡反応係数に対応し、大文字は反応物であり、生成物はすべてガス状です。

それぞれの反応方向を個別に考慮すると、それらの発生率(Td)は次の式で与えられます。
*直接反応:aA + bB→cC + dD
すべて直接 = K直接. [THE]ザ・. [B]B
*逆反応:cC + dD→aA + bB
すべて逆 = K逆行する. [Ç]ç. [D]d
物質量(K)の濃度に関する化学平衡定数ç)および分圧(KP)はKを割ることによって与えられます直接 Kによって逆行する.
だから私たちは持っています:
K直接. [THE]ザ・. [B]B = 1 → K直接__ = __[Ç]ç. [D]d___
K逆行する. [Ç]ç. [D]d K逆行する [THE]ザ・. [B]B
存在、Kç =_K直接_
K逆行する
だから私たちは持っています:
Kç =__[Ç]ç. [D]d___ またはKP =__(プラサ)ç. (pD)d___ |
ここで、pは平衡状態にある各物質の分圧です。
このようにして、各濃度は、反応中のそれぞれの物質の係数に対応する指数に上げられ、Kç ユニット*はありません。
さらに、強調すべき非常に重要な側面は、この表現では固体成分も純粋な液体も表すべきではありません。、変化する可能性のあるものだけがこの表現に参加するので。 固体状態の物質の物質量の濃度は一定であるため、K自体の値にはすでに含まれています。ç。 同じことが水のような純粋な液体にも当てはまります。 要するに、 気体状態および水溶液中の物質のみが発現に関与します。
以下の例に注意してください。
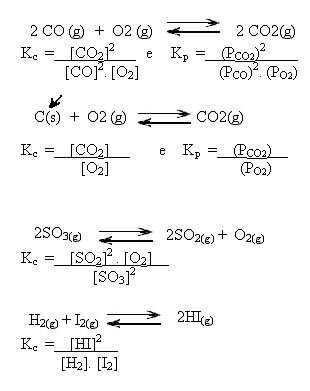
K値ç 反応物と生成物の濃度が同じかどうか、または一方が他方よりも高いかどうかを示すことができます。
- もし Kç またはKP 1に等しい(Kç = 1)、これは試薬と生成物の濃度が等しいことを意味します。
- の値が Kç またはKP 背が高い、これは、Kの式では、生成物の濃度が高いことを意味します。ç 製品は分子にあります。
- の値が Kç またはKP 低い、これは、Kの発現において、試薬がより高濃度であることを意味します。ç 試薬は分母にあります。
* Kç とKP それらは無次元数、つまり純粋な数であり、大きさや大きさ間の関係に関連する単位はありません。
ジェニファー・フォガサ
化学を卒業
ソース: ブラジルの学校- https://brasilescola.uol.com.br/quimica/constantes-equilibrio-kc-kp.htm


