Kp を決定するために使用される頭字語です 平衡定数 分圧の観点から。 この定数は、たとえば、atm単位の平衡のガス状参加者の値で機能します。

ガス成分との化学反応を表す方程式
この方程式では、すべての参加者はガス状であるため、参加しているガスが 混合物の分圧、略語pXで表されます。
化学平衡方程式(濃度の観点から)を設定するときは、生成物を分子に配置し、反応物を分母に配置する必要があります。
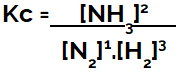
アンモニア生成平衡のKc式
の表現 圧力(Kp)に関する平衡定数 のパターンに従います Kcつまり、試薬の分圧は分母に配置され、生成物の分圧は分子に配置されます。
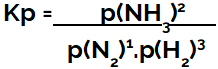
アンモニア形成平衡のKp発現
観察: の反応式が 化学バランス ガス状の参加者を提示しないでください、自動的に提示されません Kp.
例:(PUC-MG) 反応の場合:2 CO(NS) + O2(g)? 2 CO2(g)、COの分圧(NS) それは2(g) 平衡状態では、それぞれ0.2atmと0.4atmです。 システム全体の圧力は1.4気圧です。 の値 Kp 反応は次のとおりです。
今やめないで... 広告の後にもっとあります;)
a)56.2
b)40.0
c)35.6
d)28.4
e)25.6
演習で提供されるデータは次のとおりです。
一酸化炭素分圧(pCO)= 0.2 atm;
一酸化炭素の分圧(pO2)= 0.4 atm;
全圧= 1.4 atm;
このシステムのKpを決定するには、次の手順を実行する必要があります。
最初のステップ: 一酸化炭素(pCO)の分圧を決定します2).
このため、全圧(pt)はすべての分圧の合計であることを覚えておいてください。
pt = pCO + pCO2 + pO2
1.4 = 0.2 + p(CO2) + 0,4
1.4-0.2-0.4 = pCO2
pCO2 = 0.8 atm
2番目のステップ: エクササイズのKpを決定します。
このためには、平衡定数Kpの式の値を使用してください:
Kp = (pCO2)2
(pCO)2。(ほこり2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
私によって。DiogoLopesDias
学校や学業でこのテキストを参照しますか? 見て:
DAYS、ディオゴロペス。 "Kpとは何ですか?";
ブラジルの学校. で利用可能: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm. 2021年7月27日にアクセス。